- A la UNE
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- BLOG
- PRESENTATION
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
Chiralité
" Le monde est irrégulièrement semé de dispositions régulières. Les cristaux en sont ; les fleurs, les feuilles ; maints ornements de stries, de taches sur les fourrures, les ailes, les coquilles des animaux ; les traces du vent sur les sables et les eaux, etc. Parfois, ces effets dépendent d’une sorte de perspective et de groupements inconstants. L’éloignement les produit ou les altère. Le temps les montre ou les voile. "
Paul Valéry

A propos de l'harmonie de la Nature :
« Tu n’admires pas comme il le faudrait ce miracle étourdissant qu’est ta vie. »
Les Nouvelles Nourritures, André Gide
Comment peut-on lire à la fois : "La Nature aime la symétrie " (in La Recherche) et cette exclamation attribuée à Pasteur (?) "L'asymétrie c'est la vie !" ?
On peut concilier les deux affirmations en lisant le texte ci-dessous, extrait d'une conférence de rentrée des 5 Académies prononcée par le Dr Dominique Meyer, intitulée : "La Nature, leçon d'harmonie."
"Chez un très grand nombre d’êtres vivants, le développement conduit à un organisme qui frappe par sa symétrie. Le sentiment d’harmonie inspiré par les symétries de la nature a vraisemblablement accompagné l’homme dès ses origines, probablement aussi contribué à son sens esthétique. L’importance de la notion de symétrie dans les sciences ne se limite pas aux êtres vivants. Pierre Curie fit une étude de la symétrie des états physiques et postula que pour un phénomène, « les éléments de symétrie des causes doivent se retrouver dans les effets produits. »
Très récemment, Édouard Brézin a pu écrire : « La symétrie détermine le monde. »
Mais la nature aime aussi nous jouer des tours et cacher derrière une apparence symétrique de remarquables asymétries. Non seulement notre cœur n’est pas au milieu de la poitrine mais, à la suite de Pasteur, les biologistes ont découvert que les molécules constitutives du monde vivant étaient, comme la main, non identiques à leur image dans un miroir, une chiralité qui s’est révélée universelle ; ainsi, les hélices d’ADN tournent dans le même sens chez tous les êtres vivants. Cette différence avec la matière inerte reste l’une des énigmes concernant l’origine de la vie."
Allons plus loin, et évoquons un gros mot : la brisure de symétrie.
" Notre monde n’est pas parfaitement symétrique –et heureusement ! C’est grâce à une brisure de symétrie encore mystérieuse que nous sommes là. En effet, au moment du Big Bang il y a quelque 14 milliards d’années, si une quantité égale de matière et d’antimatière avait été créée, les deux se seraient annihilées et il ne serait plus rien resté (à part quelques rayonnements...). Il semble qu’un léger écart par rapport à cette symétrie ait suffit à éviter cela et à nous permettre d’y réfléchir aujourd’hui."
Présentation des travaux des trois chercheurs japonais (ou d'origine japonaise) : Yoichiro Nambu, Makoto Kobayashi et Toshihide Maskawa, prix Nobel 2008 pour leurs travaux sur la brisure de symétrie.
Cependant la brisure de symétrie ne concerne pas que la physique des particules.
Les mathématiques et la physique contemporaines montrent que le phénomène de brisure de symétrie, dans le mouvement des systèmes dynamiques non linéaires, constitue un mécanisme général possible pour l'apparition de formes.
La brisure de symétrie est donc un mécanisme très intéressant permettant d’expliquer nombre de phénomènes physiques. De nombreuses expériences illustrent simplement ce mécanisme qui viole le principe proposé par Pierre Curie :
« Lorsque les causes d’un phénomène possèdent des éléments de symétrie, ces éléments de symétrie se retrouvent dans les effets. »
L’exemple simple est celui d’une transition de phase (type eau/glace par exemple) : brutalement, un paramètre dépasse un seuil critique et le comportement du système change du tout au tout.
Regardons ce qui se passe au niveau du vivant. Lors de la formation de l’embryon on observe un phénomène tout à fait intéressant de brisure de symétrie. En effet, l’embryon de la plupart des animaux semble être au départ une grosse cellule parfaitement sphérique.
"Comment aboutit-on alors à des animaux ayant deux axes bien distincts : un axe antéro-postérieur et un axe dorso-ventral ? Autrement dit, comment la nature a-t-elle réussi à briser la symétrie sphérique de l’embryon ?"

L’ovule est une grosse cellule, et c’est la mère qui crée la première brisure de symétrie en localisant des ARN messagers dans cette cellule, définissant deux pôles (qu’on appelle animal et végétal; le pôle végétal correspond au “jaune” de l’oeuf par exemple). La symétrie passe alors de sphérique à cylindrique.
"Le second mécanisme de brisure de symétrie qui va définir l’axe dorso-ventral est tout à fait fascinant. Le spermatozoïde, lors de son entrée dans l’ovocyte, va déclencher une sorte de transition de phase. Des microtubules, auparavant totalement désorientés, vont tout d’un coup s’orienter dans la même direction. L’effet est spectaculaire : les microtubules tirent sur l’enveloppe rigide de l’ovocyte, appelée cortex, qui va alors littéralement “tourner” autour du cytoplasme de la cellule, (un peu comme si les plaques tectoniques au-dessus du manteau se mettaient toutes à bouger dans la même direction, si bien que l’Europe se retrouverait au pôle Nord !). Ainsi, l’ancien pôle végétal sur le cortex se retrouve “décalé” par rapport au pôle végétal du cytoplasme; une protéine appelée beta-caténine va alors s’y accumuler et ainsi définir la future zone dorsale ce l’embryon ! Le vivant, c’est vraiment extraordinaire !"
Référence : www.gastrulation.org
Radioscopie

Je suis vierge, j'oublie Descartes, La Mettrie, Canguilhem...
Et je contemple le corps de cette femme en sa parfaite enveloppe.
La symétrie est remarquable, la peau est lisse, soyeuse, la chair appétissante.
Elle séduira...
Nulle empathie n'émane du visage. Le regard est vide, inexpressif, aucune pensée n'est à l'oeuvre .
" au sortir du tombeau, le Christ ressuscitant de Piero della Francesca n’a pas un regard d’homme. Rien d’heureux n’est peint sur son visage - mais seulement une grandeur farouche et sans âme, que je ne puis m’empêcher de prendre pour une résolution à vivre. Car le sage comme l’idiot exprime peu. " A.Camus
Sous le sein gauche le moteur ronronne.
Les festons du soutien-gorge pointent le nombril. Là, sous la peau, les entrailles s'étalent dans tous les sens, les viscères gargouillent, la vie avance, tant bien que mal, dans le désordre, l'asymétrie.
Les franges de la ceinture conduisent à l'entre-jambe où une blessure
[accueille] des géomètres de hasard
[qui vont]Bâtir de rien des chagrins assistés
En y creusant parfois pour le péché
et perpétuer l'espèce.
Patiens Machina !
Chiralité moléculaire
Tous les cours abordant la notion d'asymétrie commencent de la façon suivante :
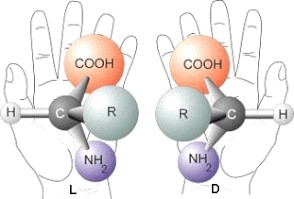
Un composé chimique est chiral, du grec « χειρ » (la main), s'il n'est pas superposable à son image dans un miroir. Si une molécule est chirale, elle possède deux formes énantiomères : une lévogyre (en latin laevus : gauche) et une dextrogyre ( en latin dextro : droite).
Gauche et Droite font référence au sens de rotation du plan de polarisation quand une lumière polarisée traverse une solution contenant une molécule chirale (le pouvoir rotatoire).
Ici une remarque très importante : deux énantiomères ont exactement les mêmes propriétés physiques (à l'exception du pouvoir rotatoire) et chimiques dans un milieu achiral ("symétrique").
Ceci n'est plus vrai en milieu chiral
Les objets chiraux sont nombreux dans la vie courante (chaussure, hélice...).
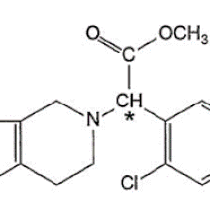
Regardons la molécule très simple, un alpha-aminoacide, représentée ci-dessous :
On observe que le carbone, tétravalent, porte 4 groupes différents. On appelle un tel carbone, un carbone asymétrique. Toute molécule qui comporte un carbone asymétrique est forcément chirale, tout simplement parce qu'une telle molécule est dépourvue de plan de symétrie, de centre de symétrie et d'axe impropre de symétrie.
Le problème se complique quand une molécule complexe possède plusieurs centres d'asymétrie (ou centres stéréogéniques). Il faut alors recenser les éléments de symétrie, déterminer les groupes de symétrie... ce qui pour un étudiant aujourd'hui n'est pas simple !
Mais pourquoi cette propriété de chiralité est-elle aussi fondamentale ?
L'asymétrie, la propriété de chiralité, sont au cœur même de l'origine du vivant. L'interaction de substances exogènes avec les organismes vivant est donc le plus souvent conditionnée par des problèmes de stéréochimie.
Nous allons le montrer dans le domaine thérapeutique et dans le domaine des odeurs et du goût.
Chiralité et médicament
Les deux énantiomères d'un médicament chiral peuvent avoir des propriétés pharmacodynamiques et pharmacocinétiques fort différentes La recherche et le développement de médicaments chiraux posent donc des problèmes de stéréochimie. Ainsi, diverses interactions de nature pharmacocinétique peuvent impliquer des énantiomères, lorsque par exemple l'un inhibe le métabolisme de l'autre et modifie ses effets. Il arrive aussi qu'une tierce substance inhibe stéréosélectivement le métabolisme d'un des énantiomères.
En 2004, les quatre médicaments les plus vendus en Amérique du nord étaient deux statines (anticholestérol) : l'Atorvastatin (Liptor/Tahor) et le Simvastatin (Zocor), un anticoagulant : le Clopidogrel (Plavix) et un IPP (inhibiteur de la pompe à protons) : l'Esomeprazole (Inexium en France), tous sous forme optiquement active.
Beaucoup d'autres spécialités célèbres possédent une activité optique. Des anti viraux par exemple comme l'Oseltamivir (Tamiflu)
ou le Zanamivir (Relenza) ou des molécules plus banales comme le propanolol (un béta bloquant)
dont seule la forme (S) est active.

Pour comprendre l’implication de la stéréochimie dans l’activité d’une substance, il faut dire un mot du paradigme de la clé et de la serrure.
Le paradigme de la clé et de la serrure décrit le principe fondamental des mécanismes vitaux. La vie s’organise grâce à des interactions spécifiques entre les molécules.
Dans la grande majorité des cas, une des composantes de ces interactions, le récepteur, est une protéine chirale qui comporte un site actif conformé pour interagir uniquement avec le substrat visé.
Donc pour qu'une substance ait une activité biologique il faudra trouver la bonne clé pour le récepteur cible.
Les médicaments sont presque tous des substances étrangères à l'organisme, pour agir ils vont notamment utiliser les lieux d'activité des agents qui assurent les fonctions normales de l'organisme ou qui entraînent des dérèglements pathologiques.
Quels sont ces agents : les neurotransmetteurs (dont je parle par ailleurs), les hormones, les enzymes, les systèmes de transport (pompe, canaux ioniques)...
La fixation du ligand (ici le médicament) entraîne un changement de conformation de la molécule réceptrice et provoque son
activation. Cette activation déclenche une succession d'événements dans les cellulaires membranaires qui amplifient le stimulus initial, ce qui aboutit à un effet physiologique donné.
Le récepteur a deux propriétés fondamentales :
- il reconnaît spécifiquement un médicament,
- il produit des effets en réponse au médicament.
La première étape est donc la fixation du médicament sur le récepteur et évidemment cette fixation de la clé sur la serrure est dépendante de stéréochimie de l'un et de l'autre.
L’interaction d’un récepteur avec deux ligands énantiomères va conduire à deux complexes diastéréomériques aux propriétés spécifiques. L'activité de deux molécules énantiomères peut donc être différente, voire radicalement différente et les demandes d'AMM doivent bien sûr prendre en compte cette composante stéréochimique.
Le cas de la thalidomide
La thalidomide est un phtalimido-glutarimide. C'est un médicament sédatif et hypnotique.
Un effet tératogène catastrophique sur le développement fœtal a été observé dans les années 60 provoquant des déformations des membres (amélie, phocomélie) induit par la capacité du médicament à inhiber l'angiogénèse - en interférant avec le développement des vaisseaux sanguins du fœtus. La molécule a un effet d'intercalation dans les molécules d'ADN.
La thalidomide existe sous deux formes énantiomères, formes L et D, n'ayant pas les mêmes effets.
La forme L protège contre les nausées et inhibe la production de TNFα (ce explique son efficacité dans le traitement de certaines tumeurs ou syndrome inflammatoire), l'autre a des effets tératogènes.
Malheureusement, les deux formes pouvant se convertir l'une en l'autre in vivo, l'effet tératogène n'aurait pas été évité en n'administrant qu'une forme.
Les deux énantiomères de la thalidomide :

Chiralité, odeur et goût
Le prix Nobel 2004 de physiologie ou de médecine a consacré les travaux de deux chercheurs américains, Richard Axel et Linda Buck, pour leur découverte en 1991 de la famille de gènes des récepteurs olfactifs.
L'odorat provient de l'interaction entre des molécules odorantes et une région de notre cerveau appelée Epithelium olfactif où se trouve les récepteurs olfactifs (OR).
Chez l'humain, les gènes codant pour ce type de récepteurs sont au nombre de ~1000 mais seulement environ 300 sont fonctionnels. Ils semblerait donc qu'au fur et à mesure de notre évolution, nous ayons perdu le besoin de différencier les odeurs. Ce qui est certainement lié au fait que notre odorat ne joue plus un rôle primordial dans nos vies quotidiennes : recherche de nourriture, danger des prédateurs....
Je parlerai par ailleurs des parfums et de l'olfaction.
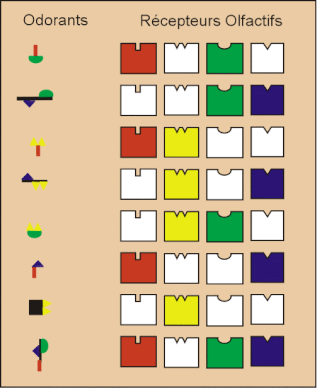
On doit tout de suite noter que la relation structure/odeur est plus complexe que celle des relations structure/activité. Une des raisons tient au fait que la "réponse" n’est pas une propriété physique ou une activité biologique mesurable, mais une perception qui ne peut être que décrite qualitativement par l'homme.
De nombreuses études de relations structure/odeur, réalisées ces dernières années, ont confirmé que l’odeur d’une molécule est liée, de manière plus ou moins complexe, à sa structure spatiale.
Le fait qu’un grand nombre de couples d’énantiomères aient des odeurs différentes montre l’importance de la structure tridimensionnelle des odorants. Mais cette différenciation stéréochimique n’est pas générale.
Des listes assez exhaustives ont été établies à ce sujet.

Quelques exemples d'odeur et de goût liés à la stéréochimie
La carvone, le limonène (deux terpènes) ont des énantiomères ayant des odeurs différentes :
- la L-carvone (lévogyre) est le constituant majeur des essences de menthe verte, tandis que la D-carvone (dextrogyre) est présente dans les graines de carvi (cumin). Les deux molécules possèdent une odeur différente alors que leur composition chimique est rigoureusement la même.
- le L-limonène a une odeur de térébenthine,
- le D-limonène a une odeur d'orange.
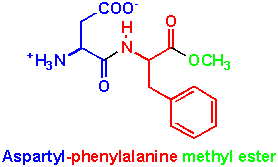
Il faut noter que seul le dipeptide constitué des énantiomères (L) de ces deux aminoacides a un pouvoir édulcorant.
Il y a deux récepteurs sur les papilles, le premier reconnaît le sucre et le second l'aspartame, ce qui suppose 2 mécanismes de reconnaissance du sucré. L'aspartame a un pouvoir sucrant environ 200 fois supérieur à celui du saccharose (à poids égal). Il constitue un leurre pour le cerveau... mais le fait que le goût et l'apport calorique ne sont plus liés augmenterait le besoin en produits sucrés.
En conclusion
Symétrie, asymétrie, chiralité, stéréoisomérie... sont des mots clés pour appréhender la biologie, la biochimie, la chimie du Vivant.
Dans le domaine de la chimie pharmaceutique, la synthèse asymétrique qui a pour vocation de fournir l'énantiomère (le stéréoisomère), actif, représente un challenge considérable. On évalue à environ 150 billions de dollars le marché des molécules bioactives chirales.
Le prix Nobel de chimie 2001 a été attribué à trois ténors de la synthèse asymétrique : W.S. Knowles (Etats-Unis), R. Noyori (Japon) et K.B. Sharpless (Etats-Unis) dont les recherches sont principalement axées sur la catalyse asymétrique. Knowles est notamment à l'origine du process industriel conduisant à la L-dopa, molécule utilisée pour le traitement de la maladie de Parkinson.
Beaucoup de chercheurs français ou de spécialistes mondiaux de la stéréochimie ont regretté que le Pr Henri Kagan n'ait pas lui aussi été nobélisé ; les spécialistes de la synthèse énantio et diastéréosélectives lui doivent beaucoup. Ses travaux récents à propos de certains aspects de l'amplification asymétrique, de la résolution cinétique et de la catalyse asymétrique font autorité.
VOIR la conférence de Henri KAGAN à l'ENS Paris (2006)