- A la UNE
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- BLOG
- PRESENTATION
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
La chimie passe au vert
Les chimistes font, depuis une vingtaine d'années, des efforts considérables pour redresser l'image de leur science, pour l'accorder avec l'air du temps.
Le concept de chimie verte ("Green Chemistry") nait au début des années 1990, au moment où les États-Unis adoptent la loi de prévention de la pollution
(« Pollution Prevention Act »).
Désormais, pour lutter contre la pollution, il s'agit de privilégier la réduction des déchets industriels à la source. La chimie,
qui utilise et rejette des substances toxiques qui polluent terre, air et eau, est concernée à plus d'un titre.
La crise économique, qui accompagne cette prise de conscience écologique, incite aussi aux économies. La chimie dont les process
impliquent souvent des matières premières coûteuses et conduisent à de nombreux sous-produits non utilisés, est là aussi dans le collimateur.
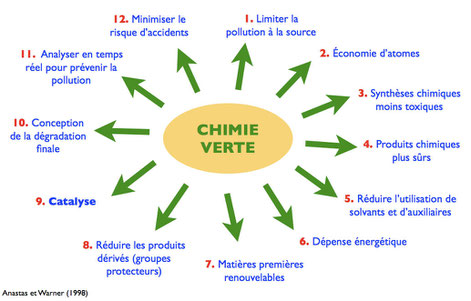
C'est Paul T. Anastas et John C. Warner qui énoncent, en 1998, les douze principes nécessaires à l'établissement d'une chimie durable :
• Prévention : limiter la pollution à la source plutôt que
devoir éliminer les déchets ;
• Économie d'atomes : optimiser l'incorporation des réactifs
dans le produit final ;
• Conception de synthèses chimiques moins dangereuses qui
utilisent et conduisent à des produits peu ou pas toxiques ;
• Conception de produits chimiques plus sûrs : efficaces et
moins toxiques ;
• Réduction de l'utilisation de solvants et d'auxiliaires
;
• Réduction de la dépense énergétique
;
• Utilisation de matières premières renouvelables au lieu de
matières fossiles ;
• Réduction des produits dérivés qui peuvent notamment générer
des déchets ;
• Utilisation de la catalyse ;
• Conception des substances en intégrant leur mode de
dégradation finale ;
• Mise au point de méthodes d'analyse en temps réel pour
prévenir la pollution ;
• Développement d'une chimie sécuritaire pour prévenir les
accidents, les explosions, les incendies et les rejets.
Green chemistry : Theory and Practice, Oxford University Press, New
York, 1998
Le challenge est donc considérable, mais on peut d'ores et déjà noter, sur chacun de ces points, des avancées très
significatives.
Je ne vais pas reprendre tous les items (voir les quelques références bibliographiques à la fin du document et le podcast vidéo du
CNRS qui suit) mais évoquer quelques exemples qui illustrent ces progrès.
La chimie dans l'eau
L'obligation d'utiliser des solvants, souvent très toxiques et qui donc posent des problèmes de manipulation et d'élimination, est
l'une des plaies de la synthèse organique.
Trop longtemps le chimiste a fait fi des règles de sécurité élémentaires. Le benzène et autres hydrocarbures éminemment dangereux,
furent par exemple longtemps utilisés " à ciel ouvert " dans des laboratoires universitaires (certains collègues et amis l'ont payé très cher 30 ans plus tard).
Pourquoi donc ne pas travailler dans l'eau !
La synthèse en phase aqueuse a beaucoup d'avantages. L'eau est un solvant bon marché, non toxique et ininflammable. Dans ce
milieu, les réactions peuvent généralement être menées dans des conditions douces et l'on sait maintenant que les rendements et sélectivités peuvent être excellents.
Malgré tout, l'eau restait un solvant marginal en synthèse pour deux raisons majeures : la faible solubilité des composés
organiques, généralement hydrophobes, et la difficulté d'isolement des produits à l'issue de la réaction.

Le premier point a été résolu par l'utilisation de cosolvants miscibles à l'eau, de milieux biphasiques et/ou l'utilisation de surfactants et le second par l'utilisation de solvants d'extraction lorsque cela est possible... mais alors on s'écarte alors du concept de chimie verte...
C'est pour cette raison que l'utilisation de supports hydrosolubles, sur lesquels les réactants sont temporairement fixés, se
généralise pour la chimie en phase aqueuse. Cette approche permet d'isoler facilement le produit de la réaction et de recycler le support.

De nombreuses autres méthodes ont été mises au point pour améliorer l'hydrophilie des réactifs :
- l'introduction de groupes fonctionnels polaires permettant une solubilité au moins partielle dans l'eau,
- l'utilisation de la catalyse micellaire en présence de tensioactifs non ioniques,
- ...
Des améliorations significatives sont régulièrement publiées à propos de la chimie dans l'eau avec par exemple l'utilisation des
microondes, la biocatalyse, les réactions en temps quasi-critique de l'eau...
Les rendements obtenus dans de telles réactions peuvent être bien supérieurs à ceux observés avec des solvants organiques, la
formation de produits insolubles dans l'eau permet souvent une récupération facile des produits de réaction.
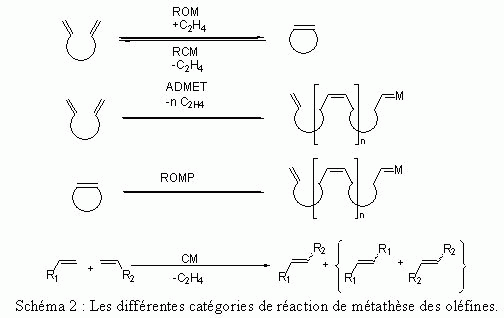
Économie d'atomes : les réactions de métathèse

Les réactions de réarrangement du squelette carboné sont par principe économes d'atomes (tous les atomes utilisés dans les
réactifs se retrouvent dans les produits désirés).
Parmi elles, les différentes réactions de
métathèse ont connu ces 10 dernières années un essor fulgurant du fait de leur utilisation en chimie fine (synthèse totale, pharmacochimie...).
Il s'agit d'une vieille réaction découverte par le français Yves Chauvin, chercheur à l'IFP, à propos du réarrangement d'oléfines, qui a dû son succès tardif à la mise au point de catalyseurs très performants (des complexes
de métaux de transition : molybdène, ruthénium) par les américains Richard Schrock (qui a utilisé plusieurs
dérivés du molybdène) et Robert Grubbs (qui utilise la formation d'un alkylidène-ruthénium aussi
appelé catalyseur de Grubbs).
Ces trois chercheurs ont obtenu le prix Nobel de chimie en 2005.
Le potentiel des réactions de métathèse en chimie fine est énorme (voir ci-dessous quelques types de métathèse des oléfines), de
très nombreuses synthèses totales y ont recours aujourd'hui.
Économie d'énergie
Les chimistes se sont évidemment penchés sur l'amélioration des rendements et des vitesses de réaction. Deux techniques
expérimentales ont été en particulier développées depuis une vingtaine d'années.
La synthèse sous micro-onde

Elle a permis dès le début des années 90 d'augmenter très sensiblement les vitesses de réactions pour un grand nombre de synthèses. Réalisée sur support solide, elle se généralise.
L’activation micro-onde résulte de deux contributions :
• une d’origine purement thermique résulte de l’agitation moléculaire causée par l’inversion
des dipôles avec les alternances du champ électrique,
• une contribution spécifique, d’origine électrostatique liée aux interactions de type
dipôles-dipôles entre les molécules polaires et le champ électrique, qui a un effet direct sur la cinétique en diminuant l’énergie d’activation.
La synthèse sous ultrasons
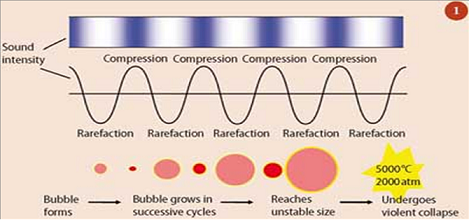
Le terme sonochimie est utilisé pour décrire les processus chimiques et physiques qui se produisent en solution grâce à l'énergie apportée par les ultrasons.
Ces effets sont reliés au phénomène de cavitation qui
correspond à la formation et à l'implosion de microbulles de gaz dans les liquides sous l'effet des ultrasons. En implosant, ces microbulles de cavitation libèrent d'importantes quantités
d'énergie sous forme d'une intense chaleur locale, d'ondes de choc et de microcourants acoustiques.
Chaque bulle de cavitation se comporte comme un microréacteur.
Des améliorations spectaculaires des rendements, des vitesses de réaction et parfois de la sélectivité, ont été observés dans de
nombreux domaines de la synthèse organique (chimie hétérocyclique, chimie radicalaire...) et des biotechnologies.
Le concept de chimie douce
Le concept de chimie douce a été énoncé par Jacques Livage qui souhaitait synthétiser des matériaux en s’inspirant du vivant. La chimie douce consiste donc à préparer des
composés sans apport énergétique notable, à température quasi ambiante. Réactifs et solvants toxiques sont bien entendu exclus.
Ces synthèses s'apparentent aux réactions mises en jeu dans les polymérisations organiques. Celles conduites en utilisant le
procédé sol-gel connaissent un grand succès.

Le procédé sol-gel
Les techniques « sol-gel » permettent, par polymérisation de précurseurs moléculaires en solution, d’obtenir des matériaux vitreux sans passer par la fusion.
On peut ainsi réaliser des matériaux purement inorganiques, ou synthétiser des verres hybrides organo-minéraux. La synthèse sol-gel a donc ouvert de vastes perspectives dans le domaine des matériaux vitreux.
La chimie douce est donc au carrefour de la chimie minérale, de la biochimie et de la chimie organique. Elle peut conduire à des structures mixtes combinant le
minéral et les molécules organiques, dans lesquelles une partie minérale encapsule des molécules complexes qui
préservent ainsi leurs propriétés.
Chimie verte : la bio-inspiration voie royale
L’observation des systèmes vivants peut être source d’inspiration pour favoriser les innovations en science des matériaux.
Cette nouvelle approche biomimétique (ou bio-inspirée) est révolutionnaire car " elle ne repose pas sur ce que nous pouvons prendre dans la nature, mais sur ce que nous pouvons en apprendre " (C.Sanchez).
Il s'agit donc d’identifier des modèles biologiques pertinents et de repérer ce qui fonctionne dans la nature... après 3,8 milliards d’années de recherche, de développement...!
La conversion de l’énergie solaire en carburant est un exemple de ce que le monde vivant peut nous suggérer.
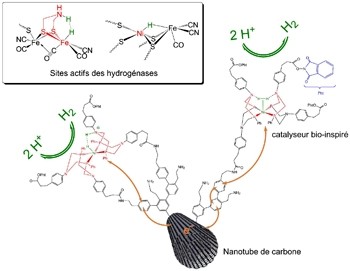
Certains organismes vivants sont capables d'utiliser l’énergie solaire pour transformer l’eau en oxygène et en hydrogène. Pour ce faire, ces microorganismes ont élaboré des systèmes enzymatiques incroyablement sophistiqués et efficaces en n’utilisant que des métaux très abondants alors que les réactions mises au point par les chimistes nécessitent des métaux nobles comme le platine ou le palladium.
S'inspirant de ce modèle, le groupe de M. Fontecave et V. Artero a pu élaborer, pour la première fois, un matériau capable de catalyser, comme le fait le platine, aussi bien la production d’hydrogène à partir de l’eau (pour une utilisation dans les électrolyseurs), que son oxydation (pour une utilisation dans les piles à combustible).
Ce matériau original est constitué d’un complexe de nickel, qui reproduit certaines caractéristiques des hydrogénases, greffé sur des nanotubes de carbone choisis pour leur importante surface potentielle de liaison du catalyseur et pour leur grande conductivité électrique.
Le process est en cours de développement.
L'exploitation du modèle vivant peut s'étendre à de nombreux domaines.
On sait par exemple utiliser des piles microbiennes pour transformer l’énergie chimique de déchets organiques en énergie électrique tout en dépolluant.
La médaille CNRS de l'innovation 2014 a ainsi récompensé le groupe montpelliérain de Claude Grison, qui a su tirer partie de la capacité adaptative remarquable de certains végétaux à accumuler certains sels métalliques (Zn, Ni, Mn, Cu, Pd, Al) dans des conditions de sols très concentrées, faisant d'une pierre deux coups : réhabiliter de sites miniers tout en produisant des biocatalyseurs.
Voir les cours de Marc Fontecave au Collège de France :
Chimie des processus biologiques
Lire : Vers une chimie douce bio-inspirée (J. Livage)
Voir, ci-dessous, la conférence de Jacques Livage intitulée :
Chimie douce et matériaux bio-inspirés