- A la UNE
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- BLOG
- PRESENTATION
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
« La vie est dominée par des actions dissymétriques dont nous pressentons l’existence enveloppante et cosmique. Je pressens même que toutes les espèces vivantes sont primordialement, dans leur structure, dans leurs formes extérieures, des fonctions de la dissymétrie cosmique »
Pasteur (1883)
Pour qui s’intéresse à la chimie du vivant, à la chimie des biomolécules, à la biologie moléculaire, aux médicaments, aux parfums, à la phytothérapie… à la chimie prébiotique… la connaissance de la stéréochimie – la chimie qui appréhende les structures et les réactions en trois dimensions- est incontournable.
L’aspect statique de la stéréochimie permet de définir une nouvelle forme d’isomérie : la stéréoisomérie. Des stéréoisomères ont la même formule chimique, mais diffèrent par l’orientation spatiale de leurs atomes.
L’aspect dynamique permet d’expliquer le déroulement des réactions chimiques ou biochimiques et d’en explorer les mécanismes.
Les cours de stéréochimie abondent sur le Net (les meilleurs sont en anglais) et ce n’est pas du tout ici mon propos. Néanmoins, avant de suivre le fil du thème « chimie et vivant », je suis contraint de présenter quelques notions très élémentaires. Les non scientifiques pourront aller directement aux épisodes suivants.
Deux mots d’histoire
L’histoire – presque contemporaine- de la stéréochimie, du début du XIXème siècle au milieu du XXème siècle, peut-être abordée à partir des découvertes de 5(6) grands savants.
Jean-Baptiste Biot (1774-1862), physicien, astronome et mathématicien, est toujours le plus jeune membre élu de l’Académie des sciences (il y fit son entrée à 25 ans).
L’histoire de la stéréochimie commence en 1815, lorsque Biot observe que certaines substances (par exemple des sucres) dévient « la lumière polarisée ».
La lumière ordinaire vibre dans des plans multiples. Si l’on sélectionne l’un de ces plans au moyen d’un polariseur on obtient de la lumière polarisée.
Biot constate également que le « pouvoir rotatoire » est fonction de la concentration de la solution.
Les substances capables de faire tourner un plan de lumière polarisée seront dites «optiquement actives." Il a fallu plus de 30 ans pour comprendre la cause de la rotation de la lumière polarisée.
L'année 1815, pendant laquelle Biot devint membre de la Société royale de Londres, marque une date capitale dans la carrière du savant, par la découverte qu'il fit du pouvoir rotatoire moléculaire de certaines substances. Auparavant il avait étudié, avec Malus, les phénomènes de polarisation, mais sans ajouter rien d'essentiel aux beaux résultats obtenus par son camarade d'école. Non seulement le fait constaté en 1815 avait une réelle importance intrinsèque; mais l'esprit merveilleusement ouvert et les connaissances variées de l'inventeur surent en accroître la portée, en suscitant des applications pratiques, soit à l'industrie, pour l'étude des liqueurs sucrées, soit à la thérapeutique, pour obtenir le diagnostic du diabète. Quarante-cinq ans après, dans un mémoire (Annales de Chimie et de Physique, mai-juin 1860) qu'il appelait son « testament scientifique », Biot se plaisait à relater les circonstances de sa découverte, en y rattachant, avec une satisfaction justifiée, les recherches de M. Berthelot sur l'isomérie, ainsi que les mémorables travaux de M. Pasteur sur le pouvoir rotatoire des tartrates.
Louis Pasteur (1822-1895)
Nous avons vu tout l’intérêt que Pasteur portait à l’activité optique. Pour Pasteur cette activité est liée à la dissymétrie des molécules, qui est la signature du « vivant ».
En
1848, Pasteur effectue la première résolution (manuelle !) d’un mélange racémique d’acide tartrique en deux composants actifs optiquement. Chacun des composés actifs
a des propriétés identiques à l'acide tartrique (densité, point de fusion, solubilité, etc.), sauf que l'un dévie le plan de polarisation dans le sens horaire (+) tandis que l’autre fait tourner
ce même plan de la même valeur mais dans le sens antihoraire (-).
Pasteur observera que les molécules obtenues par résolution sont images dans un miroir. On appelle ces stéréoisomères des énantiomères.
Pasteur découvrira également que ces énantiomères, qui ont les mêmes propriétés physiques et chimiques, sont par contre différenciés par des micro-organismes.
Il en conclura que les propriétés biologiques des substances chimiques dépendent non seulement de la nature des atomes les constituant, mais aussi de la manière dont ces atomes sont
disposés dans l'espace.
Jacobus Van't Hoff (1852-1911)
Chimiste néerlandais, il peaufine ses connaissances en chimie en Allemagne avant de rejoindre le laboratoire de Charles Wurtz à Paris, où il travaille entre 1873-1874 avec Joseph Achille Le Bel.
Dès 1874, il publie en français un ouvrage de référence La chimie dans l’espace où il propose pour la première fois une structure tétraédrique pour l’atome de carbone. Cet ouvrage est traduit très rapidement en allemand, ce qui lui assure un succès considérable malgré les sarcasmes du grand chimiste Hermann Kolbe.
Le Bel publie indépendamment à peu près la même chose en novembre 1874.
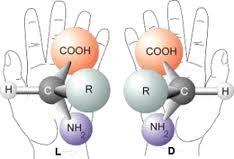
Cette structure du carbone va lui permettre de justifier l’activité optique. En effet si un carbone tétraédrique porte 4 groupements différents, il n’a alors aucun élément de symétrie et devient non superposable à son image dans un miroir. Un tel carbone est appelé carbone asymétrique.
« Crois-tu que le lait a le même goût de l’autre côté du miroir ? » demanda Alice au chat.
Lewis Carroll (1866).
Il s’agit de deux « isomères optiques », image l’un de l’autre, qui vont dévier le plan de polarisation de la lumière dans des directions opposées.
Van't Hoff a été le premier récipiendaire du Prix Nobel de chimie en 1901.
Emil Fischer (1852-1919)
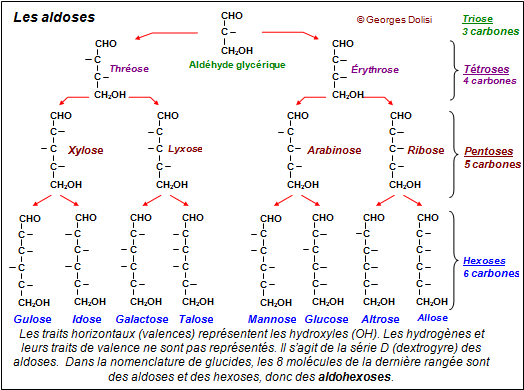
Emil Fischer sera le prix Nobel suivant, essentiellement pour ses travaux sur les hydrates de carbone (les sucres). C’est un chimiste allemand considérable et la stéréochimie tient une place éminente dans son œuvre.
C’est en 1884, que Fischer entame son travail sur les sucres qui va aboutir à un ensemble cohérent et presque complet dans ce domaine. Grâce à la découverte de la phénylhydrazine et à sa réactivité vis-à-vis des sucres il établit la relation entre le glucose, le fructose et le mannose, qu'il a découvert en 1888.
En 1890, par épimérisation entre les acides gluconique et mannonique, il montre la nature stéréochimique de l’isomérie des sucres. Entre 1891 et 1894, il publie la configuration stéréochimique de tous les sucres connus et prédit exactement les isomères possibles, en utilisant la notion de carbone asymétrique de Van't Hoff et Le Bel.
Fischer accompli
ainsi l'un des exploits les plus remarquables dans l'histoire de la chimie en identifiant les 16 stéréoisomères des aldohexoses (C6H12O6), dont le
D-glucose.
Il réalise enfin la synthèse du glucose, du fructose et du mannose, à partir du glycérol, également dans les années 1890.
Très logiquement, Emil Fischer va s’intéresser dans la dernière partie de son existence à une autre famille de molécules essentielles dans le domaine du vivant : les aminoacides, peptides et protéines.
Il prépare des aminoacides naturels et en découvre d’autres. Son laboratoire étudie également la synthèse peptidique à partir d’aminoacides chiraux.
En 1901, il découvre la synthèse du dipeptide, glycyl-glycine. Il développe ensuite des synthèses d’oligopeptides.
Vladimir Prelog
(1906-1998)
D’origine croate, né à Sarajevo (il est présent lors de l’assassinat de l’archiduc François-Ferdinand et de son épouse qui servit de prétexte au déclenchement de la première guerre mondiale), en 1941 il se réfugie en Suisse où il est accueilli dans le laboratoire de Leopold Ruzicka (prix Nobel en 1939), à l’ETH Zurich.
Prelog a reçu le prix Nobel de chimie (1975) pour la recherche sur la stéréochimie des alcaloïdes, des antibiotiques, des enzymes, et d'autres composés naturels.
On peut dire que Prelog est associé à toutes les étapes qui ont marqué l'évolution de la stéréochimie pendant plus d’un quart de siècle.
Dès 1941, Prelog réalise la synthèse d’hydrocarbures cycliques qui présentent un intérêt stéréochimique; c'est le cas par exemple de l'adamantane, dont les atomes de carbone sont situés d'une façon analogue à celle que l'on trouve dans la structure du diamant.
En 1952, il découvre l'un des premiers exemples d'effet transannulaire, lié aux tensions de cycle.
Mais c'est plus particulièrement dans l'étude des molécules chirales que Vladimir Prelog s'est distingué; en
collaboration avec Ingold et Cahn, il a proposé le premier système rationnel de nomenclature de la configuration de molécules
chirales, universellement adopté aujourd'hui.
Prelog a dépassé la notion de carbone asymétrique pour généraliser le rapport entre chiralité et éléments de symétrie d’une molécule. C'est par exemple ce que l'on observe avec le carbone central de composés spiroaromatiques comme les [6,6] vespirènes, que Prelog a d'abord synthétisés, puis dédoublés en 1969.
Ce petit rappel était indispensable :
- car la chimie de synthèse, qui débute réellement avec Berthelot n’a vraiment marché sur ses deux pieds qu’avec la prise en compte de la stéréochimie.
- Car comme l’avait pressenti Pasteur, la chimie du vivant est fondamentalement liée à des problèmes de symétrie.
Les êtres vivants ne sont pas « symétriques ». Nous sommes droitiers ou gauchers et certains de nos organes occupent une position clairement asymétrique : le cœur du côté gauche et le foie du côté droit.
La même rupture de symétrie existe au niveau moléculaire. Des biomolécules comme les aminoacides – à la base de la synthèse des protéines - ou les sucres de l’ADN et de l'ARN, sont des molécules chirales qui existent a priori sous deux formes énantiomères.
Pourtant ces molécules, telles qu’on les rencontre dans les organismes vivants, présentent une asymétrie fondamentale : les acides aminés sont tous du type gauche alors que les sucres de l’ADN et de l'ARN sont du type droit, c’est ce que l’on appelle l’homochiralité de la vie.
De même les molécules que l’on rencontre dans les agents de saveurs et les parfums possèdent des odeurs différentes selon les énantiomères.
De nombreuses manifestations de l’homochiralité du vivant ont été étudiées intensivement, mais son origine exacte, sans doute liée à l'apparition même de la vie, n'est pas totalement élucidée.
Comment le vivant a-t-il sélectionné la forme gauche des acides aminés pour construire les protéines ?
Pourquoi la forme droite a-t-elle été éliminée alors que la synthèse de ces molécules en laboratoire produit un mélange dit racémique, c’est-à-dire comportant une quantité égale des deux formes ? Ce processus de sélection est-il dû au hasard ou bien est-il d’origine déterministe ?
Nous allons, le plus simplement possible, regarder les hypothèses émises, après avoir examiné quelques conséquences fondamentales de l'asymétrie dans la chimie du Vivant.