- AVANT-PROPOS
- A la UNE
- PRESENTATION
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- ACTUALITE ARTISTIQUE
- BLOG
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Médecine de demain
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- COVID-19 - Journal d'une pandemie - 11
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
Pour Aristote, qui a beaucoup travaillé mais s'est parfois trompé, la couleur n'est qu'un mélange de blanc et de noir ; pendant des siècles cette hypothèse sera la théorie officielle des savants.
Cependant, au XIIIème siècle, l'évêque de Lincoln, Robert Grosseteste (proche des franciscains d'Oxford), dans le sillage d'Ibn al-Haytham, publie plusieurs ouvrages fameux sur la lumière (De luce) et la couleur (De colore). Il distingue ainsi le blanc (lux clara ou albedo), le noir (lux obscura ou nigredo) et 7 couleurs fondamentales.
Mais il fallut attendre le XVIIe siècle et Isaac Newton pour avoir la preuve que la lumière blanche était constituée de l'ensemble des rayonnements monochromatiques qui composent
l'arc-en-ciel.
On sait aujourd'hui que la lumière visible par l'œil humain est un ensemble d'ondes électromagnétiques dont les longueurs d'onde sont comprises entre 380 nm (violet) et 780 nm (rouge). Une particule, le photon, se déplaçant à 299 792,458 km/s dans le vide, est associée à la lumière, à qui l'on prête les propriétés d'une onde et d'un corpuscule (dualité onde-corpuscule).
La lumière blanche peut donc être décomposée pour faire apparaître des couleurs et conduire à différents types de spectres lumineux.
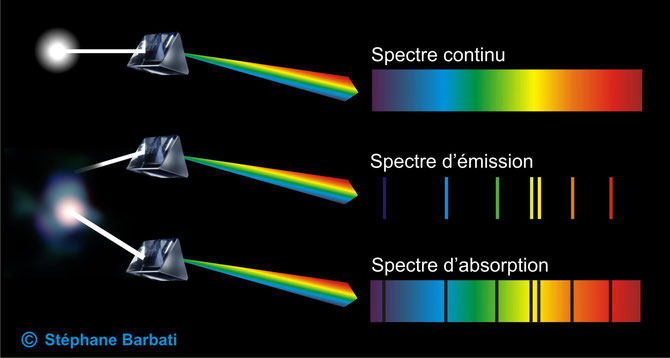
L'interaction entre la lumière (le rayonnement) et la matière
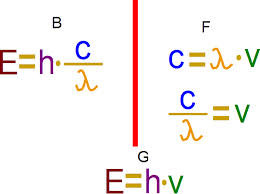
Le spectre électromagnétique décrit le rayonnement électromagnétique en fonction de la longueur d'onde - ou de la fréquence ou de l'énergie- associée à chacune de ses composantes. Ces trois paramètres sont liés :
- longueur d'onde et fréquence (c, célérité de la lumière dans le vide et ν fréquence),
- énergie et fréquence (h, constante de Planck)
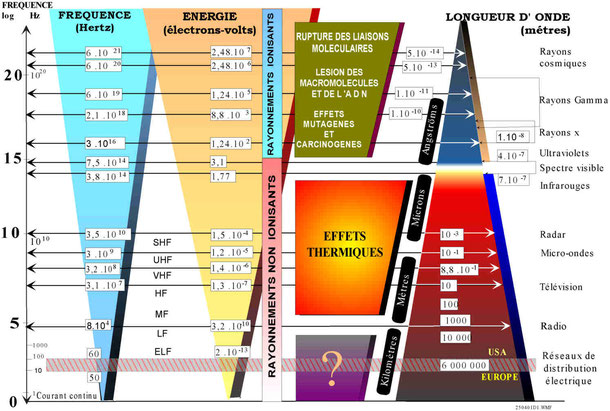
Le schéma ci-dessus, décrit le spectre électromagnétique - des rayons cosmiques (très hautes fréquences), aux ondes radio (très basses fréquences) - et son incidence sur notre vie courante.
Il montre pourquoi il faut mieux subir une IRM (onde radio) qu'un scanner (rayons X) !
Dans le spectre électromagnétique, le domaine du "visible" occupe une toute petite place .
Chacun de ces rayonnements peut interagir avec la matière, c'est à dire avec les atomes, selon plusieurs modes. En particulier ils peuvent être absorbés et provoquer une transition électronique (changement de niveau d'énergie de l'électron), voire une ionisation si l'énergie est suffisante.
Si l'absorption se situe dans le domaine du visible, la matière impactée sera colorée. Cette absorption est ainsi à l'origine des couleurs produites par les pigments, les teintures, les colorants.
L'énergie absorbée est généralement restituée sous forme de chaleur par un rayonnement infrarouge invisible.
Notons que l'absorption de la lumière (de l'infrarouge aux UV) est à la base de la photochimie.
Les chromophores
Toutes les molécules n'ont pas la capacité d'interagir avec la lumière pour "produire" de la couleur.
Pour pouvoir absorber dans la région "visible" du spectre électromagnétique, une molécule devra présenter certaines caractéristiques et notamment un (ou plusieurs) groupe chromophore.
Structurellement, les chromophores sont des systèmes électroniques conjugués, c'est à dire présentant une alternance de liasons simples et de doublets p ou pi, permettant la délocalisation du nuage électronique. Des groupes auxochromes (comme la fonction hydroxyle -OH) associés sont susceptibles d'étendre le domaine de délocalisation du nuage électronique et donc de modifier la couleur.
C'est le chimiste allemand Otto Witt qui, en 1876, a émis l'hypothèse que la coloration des molécules était due à l'existence dans leur structure de chromophores ayant la capacité d'absorber certaines fréquences lumineuses incidentes.
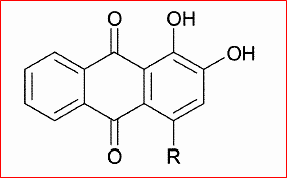
A cette époque, il avait été noté que les quinones et les composés azoïques et nitrés aromatiques, molécules fortement conjuguées, étaient très colorées. L'hydrogénation de ces composés, qui faisait disparaître les insaturations et donc la conjugaison, conduisait à des molécules peu ou pas colorées.
Par exemple, l'alizarine (à gauche), pigment rouge vif issu de la garance, est un dérivé de l'anthraquinone (à droite).
On dit qu'elle a contribué à la victoire des armées de Bismarck, en 1870, tant les pantalons "garance" de nos soldats attiraient les balles prussiennes !

Bien des facteurs - chimiques ou non - peuvent modifier les couleurs ; par exemple le pH qui peut être estimé à partir d'indicateurs colorés (voir halochromisme).
Ci-dessous l'exemple du bleu de bromthymol (une sulfonephthaléine) qui passe du fuschia (pH inférieur à 0), au jaune (pH acide), puis au bleu (pH 7,7). Une couleur verte apparaît dans la deuxième zone de virage.

Au pH de 7,1 (virage, couleur verte), deux structures en
équilibre coexistent (schéma ci-dessous).
C'est l'augmentation du pH (milieu basique) qui a provoqué l'ouverture du cycle sulfone et permis l'extension de la conjugaison (elle concerne alors les 3 cycles aromatiques) et donc le changement de couleur.

Les hommes des cavernes savaient déjà modifier les couleurs... mais par le feu.
L'examen des peintures rupestres a montré par exemple comment l'homme moderne obtenait les différents oxydes de fer.
L'oxydation par chauffage de la jaune goethite -présente à Lascaux- (FeO(OH)), conduisait à la rouge hématite (Fe2O3). En ajoutant du bois vert dans le foyer (milieu réducteur), ils obtenaient le noir de la magnétite (Fe3O4).

Jusqu'au milieu du XIXème siècle, l'homme a donc utilisé des pigments naturels d'origine végétale, minérale ou animale.
Le premier colorant synthétique, la mauvéine, est obtenu par le chimiste anglais William Henry Perkin en 1856. Il avait 18 ans et travaillait sur des dérivés de la quinine pour préparer de nouveaux antipaludiques. Ainsi va souvent la chimie...
Nous verrons que couleur et chimiothérapie ont été longtemps associées.
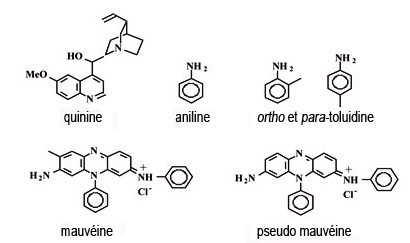
Ces synthèses ont signifié la fin des cultures de plantes tinctoriales comme la garance, l'indigo, dont le fameux bleu pastel (Isatis tinctoria) du pays de Cocagne...
Lautrec, pays de Cocagne (photos MHBL)
Magie des couleurs : Morning-Glory pool
Au XXème siècle, après les physiciens, ce sont les chimistes (voir sur le site ICI), les physiologistes, microbiologistes... et même médecins (voir sur le site ICI) qui nous ont beaucoup appris sur les couleurs, en identifiant les principes colorés des plantes et des minéraux, en associant coloration et chimiothérapie.
Aujourd'hui, les mathématiciens nous proposent des modélisations de plus en plus sophistiquées pour interpréter des phénomènes colorés, aussi complexes et spectaculaires que celui que nous offre les "piscines" du Morning-Glory , source d'eau chaude du Parc national de Yellowstone ( Wyoming, États-Unis).
On sait que les couleurs observées (image de gauche) sont liées à des colonies de bactéries qui ont pu s'installer dans le bassin, dont la source a été progressivement obstruée par les détritus jetés par les touristes.
A l'origine la couleur du bassin devait être un bleu profond (image du centre) et c'est la diminution de la température de l'eau et l'apparition des bactéries (des tapis constitués de communautés complexes de microbes, principalement des cyanobactéries et d'autres bactéries thermophiles et archées) qui a conduit au jaune-vert-bleu d'aujourd'hui .
Les auteurs ont réalisé le même travail pour le Grand Prismatic Spring (image de droite).
Biologie des couleurs

J'ai parlé de diverses façons de couleurs sur ce site :
- avec Newton et les physiciens de la "lumière",
- en chimiste, en évoquant notamment les couleurs végétales et le lien entre coloration et thérapie.
L'étude des couleurs - de la couleur- recouvre de nombreux champs disciplinaires et met en oeuvre de multiples techniques. Voici encore un domaine de recherche ou l'interdisciplinarité (*) s'impose.
La biologie de la couleur s'inscrit en effet dans cette recherche moderne, qui est interdisciplinaire et intégrative ; elle met en relation des compétences et des technologies de pointe, issues de champs disciplinaires variés.
A propos de la coloration animale, la recherche a fait un bond en avant, depuis une vingtaine d'années, grâce aux progrès technologiques en spectrophotométrie, imagerie numérique, neurosciences, analyses comparatives à grande échelle... qui permettent d'aborder de nouvelles problématiques.
La question centrale est à peu près celle-ci : comment la couleur est-elle produite et perçue, comment a-t-elle évoluée.
Ou plus précisément, comment les animaux utilisent-ils les pigments pour générer de la couleur, quelle est leur perception de la couleur, comment l'information sur les couleurs est-elle intégrée à l'ensemble des informations sensorielles et quels sont les principes qui sous-tendent l'évolution et la fonction de la couleur... Evidemment la génétique (et l'épigénétique) sous-jacente est au coeur de ces explorations.
Un magnifique article vient de paraître à ce propos. Il est signé par des chercheurs de 25 départements de recherche appartenant à des universités britanniques, américaines, suédoises, finlandaises, allemandes, australiennes, suisses et canadiennes.
Cet article est illustré par cette étonnante photo (ci-dessus) qui montre comment la couleur peut cacher ou révéler des formes.
Il s'agit d'une seiche australienne géante ( Sepia apama ) qui modifie la taille relative de ses chromatophores pigmentaires et déforme la peau recouvrant ses muscles pour passer du mode camouflage (en haut), au mode de communication (en bas), en moins d'une seconde.
(*) Nous sommes toujours au temps de Montaigne, de cette tête que trop de pédagogues français préfèrent "bien pleine plutôt que bien faite."
C'est Marc Fontecave, professeur au Collège de France qui écrit :
« Malheureusement, aujourd’hui en France, en raison d’une vision de plus en plus utilitariste de la science par les politiques, de l’archaïsme de nos enseignements universitaires, de la rigidité des structures de nos organismes de recherche, enfin du conservatisme de nos entreprises, malgré les discours (on n’a jamais autant parlé de l’importance de cette fameuse « interface chimie-biologie »), le fossé qui sépare la chimie et la biologie est, de mon point de vue, loin de se combler. Et pourtant quel bonheur, j’en suis témoin, pour un chimiste que ce questionnement sur le vivant et ce que cela implique de mondes à découvrir.»
Voir encore au XXIème siècle, des formations tubulaires, construites autour d'une discipline, de la première année de licence à la première année de master, me fait bondir. On forme de cette façon des scientifiques sourds, muets, aveugles et paralytiques, inaptes à affronter une science moderne où l'essentiel des enjeux se situent aux interfaces.
En fait, ces collègues, et notamment ceux issus des ENS, en sont toujours au quantitatif, au volume, aux têtes "bien pleines" quand plus que jamais nous avons besoin de têtes "bien faites".
Dans ce pays "perdre" une année pour mieux s'orienter, n'est que du temps perdu et mérite sanction.
J'ai des exemples multiples à ce niveau. Ainsi, une de mes plus brillantes étudiantes, qui avait eu le tort d'échouer deux fois au concours de médecine (sur des QCM imbéciles !), s'était vu refuser l'accès à de nombreuses grandes écoles sur un critère d'âge. Aujourd'hui elle dirige un des laboratoires d'un grand groupe suisse...








