- AVANT-PROPOS
- A la UNE
- PRESENTATION
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- ACTUALITE ARTISTIQUE
- BLOG
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Médecine de demain
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- COVID-19 - Journal d'une pandemie - 11
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
Médecine et nouvelles technologies

De la biologie des systèmes à la bioinformatique
Génome, métabolome
Biologie synthétique
Imagerie médicale
CRISPR-Cas9 : la révolution génétique
La médecine de précision
Théranostic
Nanoparticules
La médecine régénérative
Le patient numérique
La médecine connectée...
Génétique, biologie synthétique, numérique...
... la médecine change de dimension

Affirmer que la médecine change aujourd'hui de dimension (et je veux croire que les étudiants en médecine y sont aujourd'hui préparés) est un euphémisme.
L'Institut national de recherche en informatique et en automatique (Inria) écrit par exemple :
" Les sciences du numérique [sont] omniprésentes de la recherche à l’exercice quotidien de la médecine
La recherche médicale de pointe repose de façon massive sur les sciences du numérique. La modélisation et la simulation numériques permettent de réaliser de façon répétée des expériences in silico (sur des patients virtuels).
La connaissance du fonctionnement, normal et pathologique des organes les plus complexes (cœur, cerveau) a tiré parti des approches numériques permettant de conjuguer des informations à toutes les échelles (molécules, cellules, tissus, organes, corps tout entier). Les méthodes numériques permettent d’intégrer, de traiter et d’analyser des données de santé toujours plus hétérogènes, foisonnantes et complexes (génomique, imagerie, analyses biologiques, mesures de l’activité électrique).
Les sciences du numérique sont également omniprésentes dans l’exercice de la médecine, de la détermination des diagnostics, à la conception et à l’évaluation de nouvelles thérapies (nouveaux médicaments, chronothérapie), en passant par le suivi médical (monitoring), ou la chirurgie (assistance ou robotique chirurgicale). Elles contribuent à la formation des jeunes praticiens notamment grâce aux outils de simulation."
En 50 ans, les sciences numériques ont pénétré et révolutionné tous les domaines scientifiques -sciences dures, molles, humaines et sociales... - comment la médecine aurait-elle pu se tenir à l'écart d'un tel phénomène !
Aujourd'hui, de l'éprouvette au champ opératoire, l'informatique est partout.
Le fait que l'on puisse traiter maintenant des masses de données considérables ont permis le développement foudroyant de disciplines comme la génétique, la biologie moléculaire, la biologie synthétique, l'imagerie médicale... qui sont à la base de la réorientation de la médecine, désormais sous le contrôle des nouvelles technologies.
De la bioinformatique à la biologie des systèmes

Avec cette nouvelle aventure médicale la bioinformatique se tourne vers la biologie des systèmes, c'est à dire vers l'étude de l’organisation multi-échelle des systèmes vivants.
Vaste programme qui passe par l'utilisation du criblage à haut débit pour quantifier les changements dans le génome, mais aussi dans le transcriptome (ARNs), le protéome et le métabolome, en réponse à une perturbation donnée.
Cette analyse multidimensionnelle permettra d'analyser de multiples altérations moléculaires, afin de prédire plus finement la réponse aux thérapies ciblées.
Tout ceci parait bien compliqué mais les systèmes biologiques sont infiniment complexes, non seulement du fait de leurs propriétés émergentes mais aussi des rétroactions que ces propriétés peuvent exercer sur les structures et mécanismes élémentaires.
La biologie synthétique

C'est en combinant les concepts de la biologie des systèmes, dont le but est de comprendre les systèmes biologiques complexes dans leur globalité, avec les biotechnologies, qui ont des objectifs technologiques, que la biologie de synthèse a vu le jour. Cette dernière vise non seulement la synthèse directe d'un gène par des techniques chimiques, de génie génétique ou spécifiques aux nanotechnologies, mais aussi l'utilisation des méthodes issues des sciences d'ingénieur comme l'informatique ou l'automatique pour concevoir de façon rationnelle de nouveaux systèmes biologiques.
La biologie de synthése est une science émergente, transdisciplinaire, à la frontière de la biologie, des mathématiques, de l’informatique, de la physique et de la chimie.
Avec une approche méthodique, elle crée des systèmes biologiques qui reproduisent le comportement des systèmes naturels ou sont dotés de fonctions nouvelles, absentes dans la nature ou même inconnues. Elle permet ainsi de progresser dans la connaissance du vivant et devraient donc déboucher sur des applications majeures dans des domaines aussi variés que la santé, l’énergie, les matériaux, l’agro-alimentaire et l’environnement.
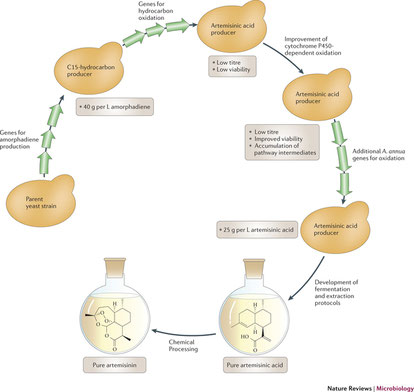
Dans le domaine de la santé on peut d'ores et déjà citer un grand succès avec la synthèse de l'artémisinine, l'un des médicaments efficaces contre les stades avancés du paludisme. Sa synthèse chimique est difficile du fait de la stéréochimie de la molécule.
En utilisant des techniques de la biologie de synthèse, on a pu créer une souche de levure produisant l'acide artémisinique, précurseur de l' artémisinine.
La production s'établit à près de 100 tonnes d'artémisinine annuelles, ce qui représente environ 1/3 des besoins mondiaux.
En ce qui concerne les outils de diagnostic un outil très performant, pouvant mettre en évidence, avec une très grande sensibilité des molécules d'acide ribonucléique (ARN) spécifiques des virus du SIDA et de l'hépatite C, permet de suivre les patients en traitement. Actuellement près de 500 000 patients sont concernés.
Tout ceci n'est qu'un début, les projets en cours foisonnent.
CRISPR-Cas9 : la révolution génétique

Le système CRISPR-Cas9 constitue un tandem "miraculeux" pour détecter une séquence d’ADN particulière, puis la découper avec précision… le tout selon un mécanisme relativement simple.
A partir de là il est possible de concevoir un ARN guide correspondant à un gène que l’on souhaite cibler, puis l’arrimer à une enzyme Cas9 pour qu’elle aille le découper ; ce qui permettrait d'établir la fonction de ce gène, ou de supprimer un gène néfaste ou déficient.
C’est ce que publient E. Charpentier et J. Doudna en 2012.
Il s'agit donc d'un outil fantastique qui devait avoir des applications sur la correction de problèmes génétiques.
Effectivement les publications s'enchaînent à un rythme effréné.
En 2014, des chercheurs de l'université du Texas travaillant sur la maladie de Duchenne (une dégénérescence musculaire due à des mutations sur le gène codant pour la protéine indispensable au bon fonctionnement des fibres musculaires parviennent à corriger cette mutation dans des embryons de souris, puis les réimplantent dans des mères porteuses. Neuf mois après leur naissance, parmi ceux chez lesquels la correction avait touché au moins 40 % des cellules, les muscles étaient parfaitement normaux !
Revers de la médaille : en avril 2015, une équipe chinoise s’est servie de CRISPR-Cas9 pour tenter de modifier le génome d’un embryon... humain ! Première mondiale, cette modification du patrimoine héréditaire de l’espèce humaine contrevient à la convention d’Oviedo.
La sonnette d'alarme a donc été tirée par de nombreux scientifiques américains.
La médecine de précision
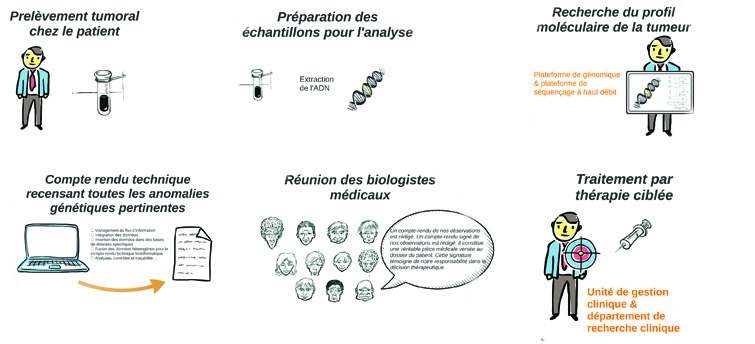

En oncologie, avec l'émergence de la médecine de précision (ou médecine personnalisée) qui prend en compte les spécificités moléculaires et biologiques du cancéreux et de sa tumeur, le nombre de données à traiter va exploser.
Cette "nouvelle" médecine, qui va permettre de proposer à chaque patient une thérapie spécifique, implique en effet la mise en place de plateformes de génétique moléculaire, le développement de séquenceurs à haut débit et donc de moyens d’analyse des données conséquents.
Autant dire qu'elle nécessite la formation de spécialistes (médecins, biologistes, bioinformaticiens) capables de se déployer dans ce nouvel environnement.
Cette approche n'est plus du tout une utopie depuis les progrès de la génétique et la possibilité, aujourd'hui, de séquencer les génomes (3,3 milliards de bases quand même !) à bas coût (1000 dollars environ)...
Dans cette optique, la constitution de gigantesque bases de données est indispensable ; elle est en cours.
En 2012, en Grande-Bretagne, Genomics lance le projet 100 000 génomes qui consiste à séquencer 100.000 génomes sur des patients du NHS atteints d'une maladie rare (ainsi que leur famille) ou d'un cancer.
Aux USA, en 2015, le président Obama lance lui-même la PMI (Precision Medicine Initiative ) qui a pour but de recueillir des données sur la santé d'au moins un million de volontaires.
" Doctors have always recognized that every patient is unique, and doctors have always tried to tailor their treatments as best they can to individuals..." B. Obama
En France, l'appel à propositions "Grands projets de génomique" a été lancé récemment. Les Chinois sont dans les startings blocks...
Théranostic et nanoparticules
Développement de tests de diagnostic moléculaire en tandem avec des thérapies ciblées
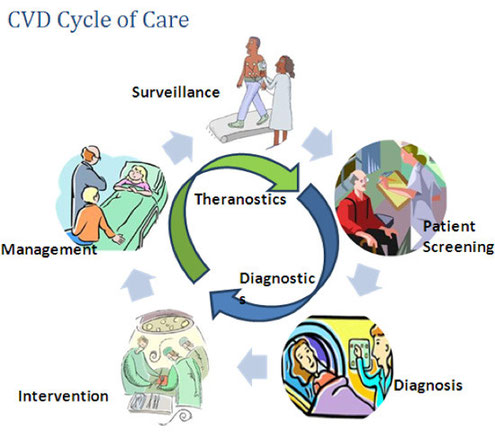
Voila une science qui a de l'avenir et dont vous allez entendre souvent parler.
De quoi s'agit-il ?
D'une approche révolutionnaire du traitement de pathologies lourdes (cancers...) qui couple les tests de diagnostic moléculaire et les thérapies ciblées.
Les domaines de la thérapie et du diagnostic deviennent en effet de plus en plus indissociables, notamment dans le cadre de cette médecine personnalisée qui émerge rapidement.
Au-delà du simple diagnostic, le théranostic a pour vocation de donner aux cliniciens les moyens de mettre en place un traitement personnalisé pour chaque patient, en contrôlant l’efficacité du traitement, en anticipant les effets secondaires inhérents aux biothérapies (aujourd’hui, 70% des nouveaux médicaments sont des biothérapies).
lmagerie moléculaire, thérapie guidée par l'image, thérapies moléculaires, biocapteurs, biomarqueurs, nanoparticules activées... c'est tout l'arsenal des nouvelles technologies biomédicales (biopharmaceutiques) qui est déployé dans le cadre du théranostic.
Theranostic et nanoparticules magnétiques

J'ai déjà évoqué l'activation magnétique des cellules tumorales (Chimie, médecine, nanotechnologies).
Les nanomatériaux offrent en effet de nouvelles possibilités pour le diagnostic et le traitement du cancer.
De nombreuses nanoparticules multifonctionnelles permettant ciblage, imagerie, thérapie, sont en cours d'étude.
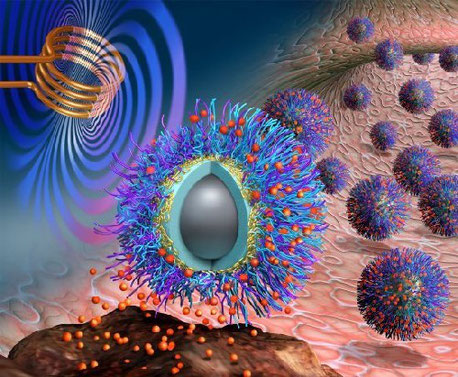
Parmi elles, les nanoparticules d'oxyde de fer magnétique (IONPs), nanocristaux biocompatibles obtenus à partir de magnétite ou d'hématite, qui présentent la particularité d'être superparamagnétiques ( magnétisme nul en l'absence d'un champ magnétique externe, mais qui apparaît en présence d'un tel champ), occupent une place choix.
Le potentiel de ces nanoparticules est considérable, tant en imagerie (IRM en particulier), qu'au niveau thérapeutique. De ce point de vue, du fait de l'adressage thérapeutique qu'elles permettent, les possibilités sont multiples :
- par encapsulation d'agents anticancéreux,
- par destruction spécifique de cellules malignes par hyperthermie magnétique,
- par le ciblage avec des nanoparticules sur lesquelles est fixée une hormone qui reconnaît spécifiquement un récepteur surexprimé à la surface de cellules tumorales...
Ces nanoparticules répondent donc tout à fait aux objectifs du théranostic. Elles permettent d'établir un diagnostic, de mettre en place une thérapie et d'en assurer le suivi (efficacité, effets secondaires...) de façon à adapter le traitement en temps réel.
En ce sens, elles sont aussi un outil de choix dans cette médecine translationnelle qui se développe actuellement.
Nanoparticules d'or et cancer
Destruction de tumeurs cérébrales en mimant le virus de la rage
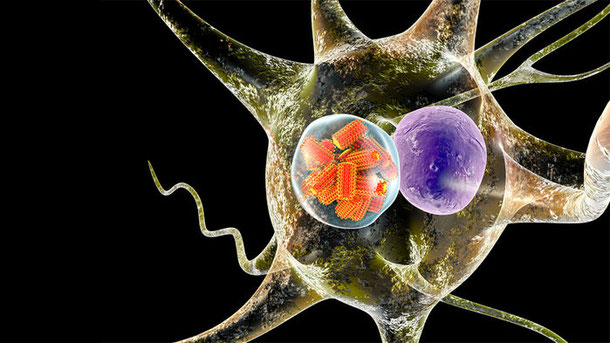
J'ai évoqué ICI l'utilisation de nanoparticules - et notamment de nanoparticules d'or - à des fins thérapeutiques.
En effet, l’adressage de molécules actives, constitue un défi majeur pour le traitement de nombre de pathologies, infectieuses, cancéreuses ou d’origine génétique.
L'extrême petite taille des nanovecteurs (nous sommes ici à l'échelle de l'atome) leur donne la possibilité de franchir de nombreuses barrières biologiques (ce qui implique des protections drastiques lors de leur utilisation).
La barrière hémato-encéphalique est en particulier un filtre extrêmement efficace, qui protège notre cerveau de nombreux types d'agents pathogènes ou toxiques.
Revers de la médaille, il est très compliqué de traiter les pathologies du cerveau par voie médicamenteuse.

Les nanoparticules peuvent alors être un moyen de vectorisation de médicaments dans ces cas difficiles. Ces dernières années, le développement de nanotechnologies dans le domaine des vecteurs de médicaments a donc pris un essor considérable.
Des nanosystèmes, capables de libérer le principe actif en réponse à un stimulus externe (modification du pH, variation de température ou application d’un champ magnétique externe), ont été mis au point.
Dans ce domaine, des chercheurs coréens viennent de publier des travaux particulièrement remarquables.
Ils ont mimé pour cela la structure du virus de la rage qui franchit sans difficulté cette barrière hémato-encéphalique (provoquant encore de nos jours des dizaines de milliers de décès).
Sur le modèle de ce virus, Yu Seok Youn et son équipe ont ainsi conçu une nanoparticule d'or dont la protéine de surface à pu se lier à des récepteurs de cellules nerveuses servant de passerelle vers le système nerveux.
Cette nanoparticule ne vectorise aucun médicament mais transporte de minuscules (submicroscopiques) barres d'or qui absorbent la lumière d'un laser infra-rouge, provoquant leur réchauffement jusqu'à 50°C, en tuant ainsi les cellules cancéreuses à proximité.
Ce traitement a été testé en laboratoire sur des souris, il réduit considérablement la taille des tumeurs.
C'est une avancée significative dans le traitement des tumeurs du cerveau ; il reste cependant à confirmer que ces nanoparticules ciblent uniquement les cellules cancéreuses, sans provoquer d'effets secondaires.
La médecine régénérative
Notre corps s'use au fil du temps, nos organes dysfonctionnent, notre squelette nous fait souffrir, nos handicaps, nos maladies, se multiplient... Sombre tableau, que quelques béquilles chimiques tentent d'éclaircir.
Nous sommes encore au moyen-âge de la médecine.
Demain, pièce par pièce, nous ferons jouvence et partirons peut-être en quête d'immortalité !
Voici en effet que monte en puissance la médecine régénératrice, ensemble audacieux de techniques et de technologies visant à restaurer notre état d' origine !
Savez-vous que, par exemple, des imprimantes 3D peuvent construire des tissus et organes qui, dans certains cas, peuvent fonctionner aussi bien que les originaux !
Certes, nous en sommes encore aux prémisses. Par exemple le système nerveux central reste très difficile à réparer. Pourtant les scientifiques pensent que les progrès observés dans l'utilisation des cellules souches pourraient permettre de restaurer la mobilité de personnes atteintes de lésions de la moelle épinière. Des expériences concluantes ont été publiées depuis quelques années.
L'observation du vivant (monde animal et végétal) peut aussi nous donner des idées. Pourrait-on, comme la salamandre régénérer un membre ? !
La revue Nature publie sur la médecine régénérative un passionnant recueil d'articles, d'accès très facile.
Imagerie biomédicale
Voir à l'oeuvre le vivant microscopique
J'ai plusieurs fois évoqué sur ce site quelques techniques performantes d'imagerie :
- la résonance magnétique, outil du chimiste dont différentes déclinaisons ont permis des avancées considérables en médecine,
- l'imagerie numérique ultrasonore dont les dernières évolutions sont particulièrement performantes, par exemple l'imagerie neurofonctionnelle par ultrasons (fUS)
La précision des images numériques obtenues permettent de suivre le fonctionnement en direct d'organes tels le coeur ou le cerveau.
Dans ce domaine, la microscopie optique était jusque là limitée par l'épaisseur des tissus à traverser. Aujourd'hui, avec la microscopie multiphotonique, on peut étudier des mécanismes dynamiques dans les tissus ou cellules vivantes .
VOIR :
- Médecine et nouvelles technologies.
Les poumons participent à l'élaboration de cellules sanguines
L'imagerie fait des miracles
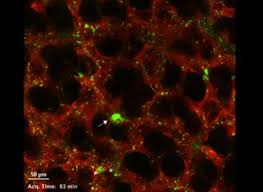
Voici un résultat considérable : des chercheurs viennent d'identifier les poumons comme site principal de production de plaquettes et comme organe ayant un potentiel hématopoïétique considérable, grâce aux performances d'une nouvelle technique de microscopie optique : l'imagerie biphotonique.
C'est en visualisant la microcirculation pulmonaire chez la souris, qu'ils ont pu observer qu'un grand nombre de mégacaryocytes circulaient à travers les poumons, où ils libéraient des plaquettes.
Ces mégacaryocytes proviennent des sites extra-pulmonaires tels que la moelle osseuse.
La contribution des poumons à la biogenèse plaquettaire est importante, elle représente environ 50% de la production totale de plaquettes ou 10 millions de plaquettes par heure.
De plus, ils ont identifié des populations de mégacaryocytes matures et immatures, ainsi que des progéniteurs hématopoiétiques dans les espaces extravasculaires des poumons.
Microscopie optique en biologie

La microscopie optique joue un rôle central en biologie Le XXème siècle a vu l’avènement des techniques de fluorescence basées sur l’absorption de lumière par des colorants intrinsèques ou extrinsèques.
Néanmoins, la forte diffusion de la lumière par les tissus épais empêche leur observation à l’aide des techniques optiques classiques.
Les microscopies basées sur des interactions non linéaires entre la lumière et les colorants permettent de contourner en partie ces difficultés, et d’acquérir des images jusqu’à une profondeur d’environ 500 microns.
C'est ce qui est réalisé avec la microscopie multiphotonique, un outil qui combine les techniques d'optiques du microscope confocal avec une excitation multiphotonique utilisant de grandes longueurs d'onde pour imager en haute résolution des échantillons en 3 dimensions, avec des fluorochromes très spécifiques.
Cet outil est particulièrement utile pour les biologistes qui souhaitent étudier des mécanismes dynamiques dans les tissus ou cellules vivantes sans infliger des dommages potentiellement létaux à l'échantillon.
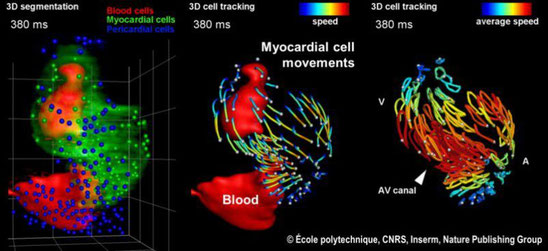
Cette technique et ses variantes peuvent permettre des visualisations étonnantes de tissus vivants "en action".
Ainsi une équipe pluridisciplinaire du Laboratoire d’Optique et Biosciences (École Polytechnique, CNRS, Inserm), et de l’Institut de Génétique et de Biologie Moléculaire et Cellulaire (Université de Strasbourg, CNRS, Inserm) a "mis au point une nouvelle stratégie d’imagerie de fluorescence permettant l’observation rapide de tissus biologiques intacts avec une résolution subcellulaire, en combinant pour la première fois microscopie à feuille de lumière et excitation biphotonique multicouleur par mélange de fréquences. Grâce à cette approche, les chercheurs ont pu imager les battements du cœur d’un embryon de poisson zébré et reconstituer en trois dimensions les mouvements cellulaires avec une résolution spatio-temporelle suffisante pour suivre chaque cellule individuellement au cours d’un cycle cardiaque. Il est maintenant possible d’envisager son application à l’étude de la formation du cœur chez les vertébrés et de pathologies aboutissant à des malformations cardiaques" . CNRS
Le patient numérique
Le docteur Ayache travaille sur ce qu'il appelle le patient numérique personnalisé. :
" Les modèles du corps humain dépendent eux-mêmes de paramètres permettant de modifier la forme et la fonction des organes simulés.
Utilisés avec un jeu de paramètres standard, les modèles sont génériques : ils décrivent et simulent la forme et la fonction moyennes des organes dans une population.
Mais avec les images médicales et l’ensemble des données disponibles sur un patient spécifique , les paramètres d’un modèle générique peuvent être ajustés grâce à des algorithmes pour reproduire plus précisément la forme et la fonction des organes de cet individu. On dispose alors d’un modèle personnalisé."
On va ainsi construire une représentation numérique personnalisée du patient en ajustant des modèles géométriques, statistiques, physiques ou physiologiques du corps humain, à ses images anatomiques et fonctionnelles.
Ce "patient numérique personnalisé" permet ensuite d'analyser plus efficacement le contenu des images médicales et de simuler de façon plus réaliste, sur des organes virtuels, l'évolution d'une pathologie ou les effets d'une thérapie.
Il s'agit donc assister le médecin dans sa pratique médicale : assister le diagnostic en quantifiant l’information présente dans les images ; assister le pronostic en simulant l’évolution d’une pathologie ; assister la thérapie en planifiant, simulant et contrôlant une intervention.
" Voilà ce qui préfigure la médecine computationnelle de demain, une composante informatique de la médecine qui n’a pas vocation à se substituer au médecin, mais qui est destinée à lui fournir des outils numériques pour l’assister dans l’exercice de sa pratique médicale au service du patient."
La médecine connectée

La santé "intelligente" passe évidemment par des objets connectés ; voici la médecine 2.0.
Le 27 octobre 2016, se tenait à Charleroi (Belgique) un séminaire sur le thème : "SMART HEALTH, où va la médecine ?"
Il était ainsi présenté :
" Nous nous intéressons cette année de manière large à la notion de SMART HEALTH.
Dérivé du concept de SMART CITY ou «ville intelligente» qui a été introduit comme outil pour englober les facteurs de production urbaine moderne dans un cadre commun et pour mettre en valeur l’importance grandissante des technologies de l’information et de la communication (TIC), le concept de «santé connectée» nous amène à nous questionner sur l’avenir du secteur des soins de santé à l’heure de technologies qui passent peu à peu d’un rôle secondaire d’aide à un rôle premier d’acteur ! A cet égard, remettre en perspective la question de la santé dans la ville connectée permet d’envisager la redéfinition de la relation triangulaire entre institutions de soins, médecins et patients."
Sur le site ARUCO (Are you Connected), on peut trouver une inventaire à la Prévert d'objets médicaux connectés : scanners, bracelets, robots, trackers, verres, masques et autres ...tétines !
Aujourd’hui, chacun de ces objets rend compte de données mesurées séparément . Mais demain... :
" En 2030, avec la standardisation des technologies de l’internet des objets, les objets connectés deviendront interopérables et seront capables de mixer les données mesurées. Vous aurez une plateforme web avec l’ensemble des données santé/bien-être mesurées sur votre personne."
Le médecin 2.0, est alors un professionnel de santé qui sait lire et interpréter vos algorithmes Big Data !
A la question : " l’intelligence artificielle pourra-t-elle dresser un diagnostic ?", Guy Vallancien (« La médecine sans médecin »), chirurgien, répond :
" Oui, bien sûr.
À partir d’informations données par le patient à l’ordinateur, ce dernier va les agréger et aboutir à des hypothèses diagnostiques. L’ordinateur m’aidera, parce qu’il ira chercher des causes, que je ne connais pas ou que je n’ai plus en mémoire. On pourra aussi observer la même chose, au point de vue du traitement. Aujourd'hui, on génotype les tumeurs. On sait que pour une même tumeur, certains malades auront des métastases et d’autres, pas. Et on le saura grâce au génome. En tant qu’urologue et chirurgien, je ne suis pas en mesure d’analyser trois milliards de bases. La machine, elle, en analysant ces données, sera en mesure de préconiser tel ou tel traitement.
Je serai dépossédé des outils qui faisaient mon métier de médecin, techniquement. En revanche, ce qui restera est la relation humaine. Le médecin sera à la disposition du malade, qui, quoi qu’il arrive, ne croira jamais l’ordinateur. Il aura toujours besoin d’une personne qui le conforte..."
Cela dit, cette (R)évolution va poser d'innombrables problèmes, à commencer par la confidentialité de toutes ces données.

