- AVANT-PROPOS
- A la UNE
- PRESENTATION
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- ACTUALITE ARTISTIQUE
- BLOG
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Médecine de demain
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- COVID-19 - Journal d'une pandemie - 11
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
mars 2012
2- ... Et la biologie devient synthétique
Méphistophélès : « Que se passe-t-il ici ? »
Wagner au laboratoire, penché sur une cornue qui fume :
– « Chut ! Une œuvre merveilleuse est prête à s’accomplir : il se fabrique un homme ».
Goethe, Faust II(acte 2)
___________
Au 243ème Congrès de l'American Chemical Society (ACS, mars 2012), la chimie du vivant est omniprésente.
Chimie pour le vivant, chimie d'après le vivant (bioinspirée)... nous sommes aux prémices d'une nouvelle révolution chimique.
Certes il ne s'agit pas comme Prométhée de créer des hommes à partir d'eau et de terre, mais de comprendre comment la matière a pu devenir complexe... et vivante.
“ What I cannot create, I do not understand ”
« Ce que je ne peut pas créer, je ne le comprends pas »

" Ne sont-ils pas romantiques ces deux brins d’ADN qui, une fois formés, s’enlacent en double hélice dans ce baiser moléculaire qui ne cesse de donner naissance à la vie ? "
Marc Fontecave, Leçon inaugurale au Collège de France : " Chimie des processus biologiques : Introduction "
Pour beaucoup de chimistes du vivant, aujourd’hui, la seule question qui vaille est :
« Jusqu’où ? »
Jusqu’où allons-nous reproduire les mécanismes de la vie ? Jusqu’à créer une vie artificielle ?
Se poser cette question, c’est sans doute aussi redéfinir la notion d’être vivant. Dans mon blog j’ai déjà évoqué ce flou du tracé de la frontière entre matière inerte et animée (Les virus sont-ils vivants ?).
A ce propos je dirai -dans un prochain épisode- un mot de la notion de cellule virale (virocell), proposée par le microbiologiste Patrick Forterre, qui s'appuie sur la phase intracellulaire du cycle viral.
Ce concept considère les virus comme des organismes cellulaires, donc vivant, et met en avant leur capacité de créer de nouveaux
gènes et de nouveaux mécanismes biologiques
Pour certains éminents chercheurs, venus d’horizons divers (chimie et biologie moléculaire, microbiologie, biochimie…), le jusqu'où est déjà dépassé ; la vraie question est :
" Comment ! "
Comment passe-t-on de la matière d’abord divisée, puis organisée, à la matière vivante, puis pensante ? Jean-Marie Lehn
Ces pionniers se retrouvent autour d’un concept, celui de «biologie synthétique», contranyme (auto-antonyme en français ?) qui désigne un nouveau champ scientifique pluridisciplinaire, qui, au-delà des sciences dures, va interpeller philosophes, médecins, spécialistes de la bio éthique…
Pour évoquer cette nouvelle approche du vivant, je vais m’appuyer sur la Leçon inaugurale de Marc Fontecave, citée plus haut, et sur le passionnant séminaire :
« De la chimie de synthèse à la biologie de synthèse / From synthetic chemistry to synthetic biology »,
qui s’est tenu au Collège de France le 5 mai 2009 et réunissait les ténors de ce vaste domaine.
Les Actes de ces travaux sont publiés dans les Comptes Rendus Chimie ICI.
___________________
Parmi toutes les définitions actuelles de la chimie, celle exprimée par Marc Fontecave me convient parfaitement :
« Au fond la chimie, c’est ce que nous avons de commun avec tous les êtres de l’univers, c’est ce qui nous rassemble : mêmes gènes, mêmes composants chimiques."
C’est elle qui nous empêche de voir dans notre voisin, blanc, jaune ou noir, autre chose que nous-mêmes.
Elle nous rattache à la Terre d’où nous venons tous, puisque nous ne sommes que le produit chimique des transformations que subissent les aliments que nous fournit cette Terre, et où nous finissons, lui redonnant pour un autre cycle de vie tout le carbone et autres éléments chimiques dont nous sommes faits.
Dans ce retour, il n’y a plus ni vivant, ni complexité, ni diversité : il y a nos molécules, froides et éternelles, révélant enfin de façon si évidente notre profonde identité chimique, cette âme des choses visibles, immuable et éternelle.»
Marcelin Berthelot, Justus Von Liebig, que j’ai déjà beaucoup cités, sont les premiers réductionnistes naturalistes, qui ne voient dans le vivant que l’expression des lois de la physique et de la chimie. J'ai parlé ici de l'affrontement entre le premier nommé et le vitaliste Pasteur.
Aujourd’hui le chimiste américain Georges Whitesides (médaille Priestley 2007), dit tout net :
« The nature of the cell is an entirely molecular problem. »
Nous voici au cœur d’une problématique pluri/multi/trans disciplinaire, qui au passage met en question nombre de nos formations universitaires beaucoup trop orientées vers une hyperspécialisation imbécile, dès le début des cursus.
Nous sommes toujours au temps de Montaigne, de cette tête que trop de pédagogues préfèrent bien pleine plutôt que bien faite.
« Malheureusement, aujourd’hui en France, en raison d’une vision de plus en plus utilitariste de la science par les politiques, de l’archaïsme de nos enseignements universitaires, de la rigidité des structures de nos organismes de recherche, enfin du conservatisme de nos entreprises, malgré les discours (on n’a jamais autant parlé de l’importance de cette fameuse « interface chimie-biologie »), le fossé qui sépare la chimie et la biologie est, de mon point de vue, loin de se combler. Et pourtant quel bonheur, j’en suis témoin, pour un chimiste que ce questionnement sur le vivant et ce que cela implique de mondes à découvrir.» Marc Fontecave
Au fond, ce que les chimistes du XXème siècle ont fondamentalement révélé, c’est la formidable unité chimique du vivant. Ce sont les mêmes molécules et macromolécules, qui en nombre limité, constituent les êtres vivants, des bactéries aux mammifères, en passant par les végétaux.
« La diversité du vivant ne résulte pas tant d’une diversité chimique que d’une combinatoire complexe dans l’utilisation de cette collection finie de molécules. C’est justement cette finitude qui permet à la chimie de jouer un rôle majeur dans l’exploration du vivant. » Marc Fontecave
Depuis plus d'un siècle, la chimie possède une faculté créatrice. Aujourd'hui elle a même la puissance de former une multitude d’êtres artificiels qui viendront s’insérer dans la nature, en sorte que la chimie peut prétendre, à l’horizon des temps, « à former de nouveau toutes les matières qui se sont développées depuis l’origine des choses, à les former dans les mêmes conditions, en vertu des mêmes lois, par les mêmes forces que la nature fait concourir à leur formation. »
Pour Marc Fontecave, « c’est bien parce que la chimie est à la fois une science de la matière « informée » et une science de la matière « transformée » que les chimistes ont toute légitimité pour participer à ce grand projet de l’homme : comprendre le monde vivant. »
______________
Dans ce feuilleton, j’ai abordé à plusieurs reprises le thème chimie et vivant, qui prend véritablement consistance avec la synthèse de l’urée, en 1828, par Friedrich Wöhler.
La chimie de synthèse a fait depuis des bonds prodigieux.
Il aura fallu près de cent cinquante années pour qu'en 1973, les efforts conjugués de deux équipes, celle de Robert B. Woodward à Harvard et celle d’Albert Eschenmoser à l’ETH de Zurich, aboutissent à l'époustouflante synthèse totale de la vitamine B12.
Que d’efforts, de temps, d’ingéniosité, de main d’œuvre… mis à contribution pour arriver à un tel résultat !
" ... L’équivalent de 150 années chercheurs et chercheuses sur une période d’environ une douzaine d’années, procédant par coups successifs, avec des techniques de joueurs d’échecs. On prépare une brique moléculaire, on en protège certaines positions, dans le but de les utiliser plusieurs étapes plus loin, on les libère au fur et à mesure afin de les mettre en réaction. Il s’agit d’une méthodologie extrêmement raffinée, très élégante, qui procède pas à pas...
...On peut dire qu’entre la synthèse de l’urée et celle de la vitamine B12, les chimistes organiciens ont appris leur métier. " Jean-Marie Lehn
On peut dire qu'avec la synthèse de la vitamine B12, une certaine approche de la chimie moléculaire avait déjà atteint son apogée.
Certes de nouvelles réactions furent découvertes, des technologies plus performantes mises en œuvre, qui ont permis une économie de temps et de coût pour ces synthèses totales, mais rien de fondamental ne vint bouleverser la synthèse chimique avant que quelques chimistes ne prennent pour modèle les constructions... du vivant !
Dans sa leçon inaugurale au Collège de France en 1980, Jean-Marie Lehn définit un nouveau concept, une nouvelle approche de la chimie :
" Au-delà de la chimie moléculaire fondée sur la liaison covalente [liaisons "fortes" entre atomes], s'étend aussi un domaine que l'on peut appeler supramoléculaire : la chimie des interactions moléculaires [liaisons "faibles"], des associations de deux ou plusieurs espèces chimiques... "
Mais que sont ces interactions moléculaires sinon le fondement même de ces processus hautement spécifiques, de reconnaissance, de transport, de régulation, de réaction... qui se produisent en biologie... !
Dès lors, cette nouvelle version de la chimie de coordination va connaître un développement foudroyant.
Les termes de reconnaissance moléculaire, d'auto-organisation, d'auto-assemblage, de site d'interaction (de reconnaissance),... de clé et de serrure... vont venir irriguer la littérature chimique.
La chimie supramoléculaire, du fait de la réversibilité des interaction non-covalentes, est une chimie dynamique... une chimie adaptative qui peut conduire à la diversité, à la sélection....
Nous voici à Darwin, à la chimie prébiotique que j'ai effleurée ICI.
Dans ce grand élan vers la biologie, la chimie devient biomimétique et même bio inspirée !
Regardons maintenant l'avancement des travaux des biologistes moléculaires au cours de ces années 70-80.
En 1970, le biologiste indien Har Gobind Khorana, deux ans après avoir reçu le prix Nobel de médecine pour ses travaux sur le décryptage du code génétique, synthétise un gène codant pour un ARN de transfert. Précurseur de la technique PCR (méthode d'amplification génique in vitro), c'est le pionnier de l’ingénierie génétique.
En 1972, Paul Berg, prix Nobel 1980, obtient la première molécule d’ADN recombinant.
En 1984, le groupe de Steven Benner est le premier à rapporter la synthèse chimique d'un gène codant une enzyme.
En 1989, le laboratoire Benner introduit le premier alphabet d'ADN élargi puis développe des systèmes d'information génétique artificiellement élargis (AEGIS).
On peut dire qu'avec Benner émerge cette « biologie synthétique », qui vise à générer, par synthèse chimique, des molécules qui reproduisent le comportement complexe des systèmes vivants, y compris leur génétique, et leur évolution.
Dans son grand élan vers la chimie, la biologie devient... synthétique !
Dans les années 2000, tout s'accélère. J'ai déjà parlé ici des travaux du groupe de Craig Venter (dont Hamilton Smith, prix Nobel de médecine).
Le 8 octobre 2007, à San Diego, ce chercheur iconoclaste annonce la création en laboratoire d'un chromosome artificiel de synthèse qu'il nomme Mycoplasma laboratorium. Ce chromosome, copie des parties substantielles de l'ADN de la bactérie Mycoplasma genitalium.
Désormais le groupe affiche pour objectif de construire une « cellule minimale » !
La biologie synthétique n’a donc pas encore accouché d’un être vivant. Mais en visant la « cellule minimale », elle y prétend.
Anne Fagot-Largeault et al
--------------------------
Dans le prochain épisode, je parlerai de cette approche biomimétique de la chimie qui commence avec les travaux du Français Jean-Marie Lehn, prix Nobel de chimie, dans le domaine de la chimie supramoléculaire.
From synthetic chemistry to synthetic biology, Anne Fagot-Largeault, Charles Galperin, François Gros, Jacques Livage, Comptes Rendus Chimie, Volume 14, Issue 4, April 2011,
Lire : François Gros, Les mondes nouveaux de la biologie, (Odile Jacob, 2012)
Biologie synthétique... deux ans plus tard (mai 2014)
Le journal Nature publie ceci...
A semi-synthetic organism with an expanded genetic alphabet
- Denis A. Malyshev,
- Kirandeep Dhami,
- Thomas Lavergne,
- Tingjian Chen,
- Nan Dai,
- Jeremy M. Foster,
- Ivan R. Corrêa
- & Floyd E. Romesberg
...
Nous avons mis au point une classe de UBP formé entre les nucléotides portant des nucléobases hydrophobes, illustrés par le couple formé entre d5SICS et DNAM (d5SICS-DNAM), qui est efficacement amplifié par PCR et transcrit in vitro , et dont le mécanisme unique de réplication a été caractérisée.
Toutefois, l'expansion de l'alphabet génétique d'un organisme présente de nouveaux défis sans précédent: les nucléosides triphosphates artificielles doivent être disponibles à l'intérieur de la cellule; les polymérases endogènes doivent être en mesure d'utiliser les triphosphates non naturels pour reproduire fidèlement l'ADN contenant l'UBP dans le milieu cellulaire complexe; et enfin, l'UBP doit être stable en présence de voies qui préservent l'intégrité de l'ADN.
Ici, nous montrons que des algues d'une manière exogène exprimé nucléotide triphosphate transporteur importe efficacement les triphosphates de deux d5SICS et DNAM (d5SICSTP et dNaMTP) dans Escherichia coli , et que la machinerie de réplication endogène les utilise pour reproduire avec précision un plasmide contenant d5SICS-DNAM...
Ainsi, la bactérie qui en résulte est le premier organisme à se propager de façon stable avec un alphabet génétique
élargie.
...
Obtention du premier organisme semi-synthétique ayant un alphabet génétique élargi...
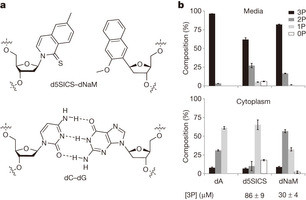
Gageons que la publication dans Nature des travaux du groupe de Floyd Romesberg, annonçant l'obtention de ce premier organisme issu d'un alphabet génétique modifié, n'a pas fini d'agiter le monde scientifique et les media...
De quoi s'agit-il ? Tout simplement de l'obtention d'un organisme (une bactérie) modifié, ayant intégré dans son génome un code génétique à 6 lettres (comportant deux bases nucléiques non naturelles), capable de se propager de façon stable, c'est à dire de produire de nouvelles bactéries ayant intégré ce nouveau code génétique.
Ross Thye & Jared Ellefson, qui dans le même numéro de Nature analysent cette publication, écrivent : " La construction d'un organisme qui se propage de façon stable avec une paire de bases d'ADN artificiel redéfinit cette fonction fondamentale de la vie."
LIRE aussi ce commentaire dans Nature : First life with 'alien' DNA. An engineered bacterium is able to copy DNA that contains unnatural genetic letters by Ewen Callaway
"Augmenter" le livre du vivant avec un alphabet génétique élargi
Vers un organisme semi-synthétique (suite, janvier 2017)
L'objectif central de la biologie synthétique - obtenir de nouvelles formes de vie - est à portée de main.
J'ai rapporté ci-dessus, l'exploit des chercheurs du groupe de Floyd Romesberg (Scripps Institute, San Diego, CA) qui ont obtenus les premiers organismes vivants (issus de la bactérie E. coli) capable de se développer avec un code génétique élargi (avec deux bases non naturelles). Ce travail ouvre la voie à la création et l'exploitation de nouvelles formes de vie.
Ils publient aujourd'hui dans PNAS un article non moins important, où ils montrent comment ils ont maîtrisé la réplication et obtenu un SSO (semi synthetic organism) stable, plus autonome, et capable de stocker l'information augmentée indéfiniment.
Ils ont notamment utilisé pour cela une technique révolutionnaire dont j'ai beaucoup parlé ici : l'édition de gènes avec CRISPR-Cas9, ce qui leur a permis d'optimiser la rétention de la paire de nucléotides non naturels. Le système immunitaire de la bactérie a été modifié de façon à exclure tout ADN ne comportant pas ces deux nucléotides.
Selon Thomas Lavergne (CNRS, Grenoble), un des contributeurs, « Nous avons même réussi à assurer une bonne réplication en insérant deux paires de bases X et Y, au départ dans la bactérie, au lieu d’une seule ... C’est important pour la suite car nous voulons pouvoir modifier plus largement l’ADN des organismes et donc placer plusieurs paires de bases X et Y à des endroits différents. »
La prochaine étape consistera à traduire ce matériel génétique en protéine synthétique, ce qui sur le plan thérapeutique peut conduire à des avancées majeures.
Contrairement à ce proclame déjà certains, il ne s'agit pas de jouer aux apprentis sorciers, mais bien de proposer une alternative aux diverses chimiothérapies en traitant à la racine les dysfonctionnements de l'organisme.
Il faut rappeler que l'un des thèmes de recherche du laboratoire de San Diego est l'antibiothérapie, recherches capitales au moment où les phénomènes de résistance aux antibiotiques les plus puissants se multiplient.
Enfin, comme le rappelle Thomas Lavergne :
« Nous avons montré qu’en l’absence des bases X et Y dans le milieu de culture, l’ADN semi-synthétique était rapidement converti en ADN naturel. Ces bases X et Y étant exclusivement synthétiques et absentes de notre environnement, la propagation de ces organismes hors des frontières du laboratoire est donc impossible. »
Ci-dessous : INTERVIEW de Thomas Lavergne, France Inter, 27-01-2017
Et enfin...
L'ADN «alien» fabrique des protéines dans des cellules vivantes pour la première fois

Ceci est le titre d'un article phare de la revue Nature du 29 novembre 2017.
C'est aussi la conclusion d'une décennie qui révolutionne notre approche du vivant.
J'ai suivi sur ce site cette aventure qui aboutit aujourd'hui à ce résultat extraordinaire : un organisme semi-synthétique est capable de produire des protéines.
La biologie synthétique vient d'atteindre son principal objectif en réinventant les aspects les plus fondamentaux de la vie.
Grâce à un alphabet génétique étendu une vie (semi) synthétique a émergé qui peut élargir le champ de la biologie moléculaire - de la biologie tout court.
Floyd Romesberg, le patron du laboratoire de San Diego qui signe cet exploit, souligne la portée de ces résultats :
" There is no biological system so fundamental and more intimately related to what we are than information storage and retrieval,...“What we’ve done is design a new part that functions right alongside the existing parts and can do everything they do.”
Rien n'est en effet plus fondamental et plus intimement lié à ce que nous sommes que le stockage et la récupération de l'information grâce à l'alphabet génétique et ses 4 lettres constituant l'ADN, devenues 6, dans ce nouvel alphabet d'un vivant devenu artificiel.
"Apprenti-sorcier" : pour faire quoi ?

Evidemment le procès en "sorcellerie" est déjà instruit à l'endroit de ces "savants fous".
Par ceux qui sans doute seront heureux de profiter dans 10 ou 20 ans de l'arsenal thérapeutique qui va se développer grâce à ces travaux.
Un exemple : nous arrivons au bout du bout de l'efficacité des antibiotiques.
De tout côté les bactéries contournent les mécanismes mis en place pour stopper leur prolifération. Les phénomènes de résistance progressent dangereusement. Les publications sur la résistance aux glycopeptides ( antibiotiques particulièrement efficaces détruisant la parois de bactéries Gram+) comme la vancomycine, dernière barrière aux infections les plus virulentes (pneumocoques...), se multiplient depuis 10 ans ; les modifications structurales du peptide (vancomycine 3.0, 2017) permettent pour l'instant de repousser une échéance qui semble inéluctable.
Il est donc clair que la production de protéines "artificielles" , qui ne pourront être reconnues par les bactéries, a un intérêt majeur.
D'une façon générale, on peut considérer que la production de molécules complexes, comme les protéines, fabriquées en utilisant des micro-organismes vivants, des plantes, des cellules animales... devient un enjeu majeur dans le domaine de la santé, même si elles ne représentent aujourd'hui que 10% du marché, principalement dans le domaine de maladies chroniques graves (comme le cancer).

Mars 2016 : Synthèse d'une bactérie possédant le plus petit génome...
Vie synthétique vs édition de gènes : deux approches complémentaires

La fulgurante ascension de la technique d'édition de gènes CRISPR-Cas9, dont je parle abondamment par ailleurs, relègue-t'elle au second plan les recherches des groupes de San Diego (voir sur le site les travaux de Floyd Romesberg et Craig Venter) qui visent à créer ex nihilo des organismes synthétiques, ou semi-synthétiques, destinés à produire médicaments, carburants et bien d'autres molécules ?
En d'autres termes à quoi bon faire compliqué en fabriquant une nouvelle forme de vie, quand il devient si facile de modifier l'existant ?
Craig Venter continue néanmoins sa route à marche forcée ; son équipe vient de décrire la synthèse d'une bactérie possédant le plus petit génome existant - JCVI-syn3.0 - (531 paires de bases pour 473 gènes). Son temps de doublement - 180 minutes - est tout à fait respectable.
Ce génome est plus petit que celui de la cellule minimale se répliquant de façon autonome dans la nature.
Cependant sur la voie de la minimisation du génome, beaucoup de chemin reste à parcourir pour trouver le bon compromis entre la taille du génome et le taux de croissance.
Jusqu'ici le groupe de Venter a plutôt fonctionné par tâtonnement, sur le mode essais/erreurs, et de nombreux points d'interrogations subsistent. Il a ainsi observé que 149 gènes (près du tiers) de ce génome avaient des fonctions biologiques inconnus, mais étaient indispensables. Pourquoi ?
En fait, ces deux approches du travail sur le vivant se situent sur deux plans différents.
Avec CRISPR, c'est un bricolage -génial- permettant la réparation de l'existant qui se développe et va donner des résultats spectaculaires très rapidement.
Les travaux sur la vie synthétique sont plus ambitieux, puisqu'ils visent avant tout à élucider le mécanisme de la vie et sa reproduction a minima. Ils se situent bien en amont et leurs applications ne se dessineront qu'à moyen terme.
Craig Venter, comme tous les pionniers de la biologie synthétique aime à rappeler cette phrase de Richard Feynman que je citais en introduction :
« Ce que je ne peux pas créer, je ne le comprends pas "
Cellule artificielle : un pas de géant
Un nouvel exploit de la biologie synthétique
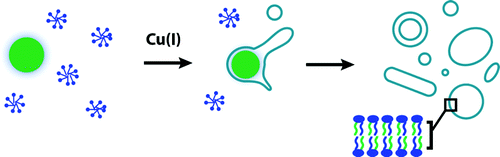
L'un des principaux objectifs de la biologie synthétique est le développement de systèmes cellulaires non naturels.
Depuis plusieurs années, Neal Devaraj, professeur de chimie et de biochimie à l'UC San Diego, dirige une équipe de recherche qui développe et explore de nouvelles réactions pouvant déclencher la formation de membranes, en particulier des sphères, caractérisant les membranes entourant les vésicules et les cellules.
Par exemple, il avait précédemment décrit une réaction de couplage biomimétique, catalytique, capable de piloter l'auto-assemblage de novo de membranes phospholipidiques.
Aujourd'hui une prépublication révèle que son équipe a mis au point un mimique de cellule.
Comme les vraies cellules, les sphères obtenues peuvent envoyer des signaux protéiques à leurs voisins, déclenchant un comportement commun. Le "noyau" parle au reste de la cellule, libérant de l'ARN qui provoque la synthèse des protéines. Ces noyaux artificiels peuvent même répondre aux signaux d'autres cellules mimiques.
Elaboration chimique d'une cellule artificielle
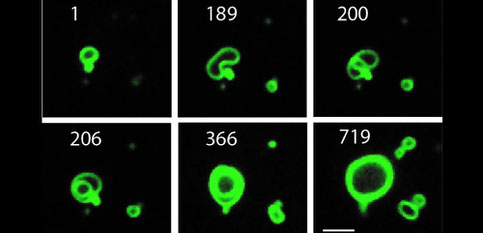
La communication entre cellules mimiques permet la répartition des tâches et la différenciation cellulaire en fonction de l'environnement local.
Les cellules d'imitation affichent également un autre attribut réaliste appelé détection de quorum (quorum sensing) dans lequel le comportement des cellules change une fois qu'elles deviennent suffisamment abondantes.
Ces cellules mimiques peuvent être fabriquées en grandes quantité, facilement stockées, modifiées chimiquement et organisées spatialement en arrangements de type tissus !

Pour mimer le fonctionnement d'une cellule réelle, Devaraj et ses collègues se sont éloignés de la nature. Ces "cellules" sont une pure construction chimique, qui n'a rien à voir avec une cellule vivante.
"Au lieu de la membrane lipidique qui enveloppe nos cellules, celles-ci portent une couche d'acrylate polymérisé. Et bien qu'ils abritent un compartiment ressemblant à un noyau contenant de l'ADN, il manque une membrane ressemblant au noyau d'une vraie cellule ; ses principaux ingrédients sont des minéraux trouvés dans l'argile."
Les chercheurs ont utilisé une puce de silicium avec des canaux microscopiques remplis de fluide pour extruder de minuscules gouttelettes contenant des matières premières, telles que l'ADN, des minéraux issus argile et des molécules individuelles d'acrylate.
Mais ça fonctionne pas mal et c'est en tout cas la cellule artificielle la plus aboutie jamais construite.
Organismes synthétiques mimétiques : quelle utilité ?
Les liposomes

Dans les maladies graves, comme le cancer, il est fondamental que le médicament atteigne sa cible.
Or l'organisme rejette tout ce qui lui apparaît comme un corps étranger.
La nanomédecine va améliorer la vectorisation de ces médicaments. Elle va permettre de transporter la molécule dans l’organisme jusqu’à une cible précise.
Pour cela elle va utiliser des nanomédicaments dans laquelle la molécule active sera contenue dans une particule mesurant entre quelques dizaines et quelques centaines de nanomètres. Cette nanoparticule protège le principe actif du médicament d’une éventuelle dégradation.
Les liposomes sont des petites vésicules dont la membrane est constituée par une double couche de lipides et un compartiment aqueux. Ils peuvent permettre de délivrer le médicament sur sa cible.
Exemple d'application : les maladies du foie
Le principe est le suivant : ces nanomédicaments sont injectés par voie intraveineuse et sont alors identifiés par l’organisme comme des corps étrangers. En réaction, l’organisme va les recouvrir par des protéines indiquant clairement leur identité de « corps étrangers » afin qu’ils soient captés par le foie. C’est un moyen efficace de traiter certaines maladies du foie en y amenant directement les médicaments.
Notons que l'organisme sait aussi leurrer les leurres !
Cellules, génomes, ADN...artificiels

Avec ces éléments biologiques de synthèse, les chercheurs espèrent mieux comprendre les systèmes biologiques et construire de nouveaux organismes capables d'accomplir des fonctions d'intérêt dans divers domaines.
En administrant des médicaments plus précisément sur leurs cibles, en traquant les cellules cancéreuses, en détectant des produits chimiques toxiques ou encore en améliorant la précision des tests de diagnostic.
Des réseaux de cellules synthétiques en interaction pourraient également former des tissus artificiels et des matériaux intelligents qui détectent et s’adaptent à leur environnement.
Craig Venter a pour ambition d’exploiter le potentiel industriel de la biologie de synthèse, en créant des fonctionnalités cellulaires sur mesure permettant de produire des composants utiles pour le secteur pharmaceutique ou chimique.
Nous avons vu comment les chercheurs de Floyd Romesberg on contraint leur bactérie à fabriquer des protéines contenant des acides aminés non présents dans la nature. Chaque acide aminé non naturel à insérer est représenté par un nouveau codon comprenant l'une des bases synthétiques de l'équipe.
En d’autres termes, leur bactérie peut lire une nouvelle extension du code génétique standard créée par l’homme, et utiliser les instructions pour produire des protéines qu’aucun organisme ne fabrique naturellement.
L'espoir est qu'un jour cette méthode pourrait être utilisée pour fabriquer de nouveaux médicaments, polymères ou catalyseurs...
Notons que la technique d'édition de gènes mise au point par Emmanuelle Charpentier et Jennifer Doudna (méthode CRISPR-Cas9) qui permet de modifier à volonté le génome d’une cellule, présente des perspectives tout aussi prometteuses. J'ai aussi largement présenté ces travaux.
En complément...
Méthodologie scientifique
De haut en bas (top down) ou de bas en haut ? (botton up)

La nature, selon une démarche botton up (de bas en haut), par un processus laborieux d'essais et d'erreurs, élabore et contrôle le vivant.
Les humains ont tendance à adopter l'approche inverse dite top down qui consiste à réduire et simplifier un problème complexe en le décomposant, afin de trouver la solution la plus efficace.
L'approche ascendante est une synthèse - qui peut conduire à l'émergence de théories à partir de la pratique (voir "le tout est plus que la somme des parties"). Il s'agit d'une construction, d'une évolution vers plus de complexité.
VOIR chimie prébiotique.
L'approche descendante est une analyse déconstructive qui va permettre de passer du macroscopique au microscopique.
Le domaine du nanomonde a été par exemple abordé par la miniaturisation (la voie descendante). Le matériau est découpé, sculpté, gravé.... pour atteindre la dimension souhaitée - micromètre, puis nanomètre -, grâce à des techniques de plus en plus élaborées.
Cependant, l’approche « ascendante » qui consiste à construire les nano-objets, atome par atome, pour obtenir des molécules puis des édifices plus complexes, rencontre de plus en plus d'adeptes.
Pour cela on dispose d’instruments comme le microscope à effet tunnel qui est capable non seulement de distinguer les atomes d’une surface, mais aussi de les déplacer.
Les chercheurs utilisent généralement les deux stratégies. L’approche ascendante est plus performante, l’assemblage se fait de manière précise, elle a de meilleures chances de produire des nanostructures avec moins de défauts et une composition chimique plus homogène.

En protéomique, la spectrométrie de masse, technique puissante d'analyse des protéines, peut permettre de lier la structure de la protéine d'ordre supérieur à la séquence d'acides aminés et aux modifications post-traductionnelles.
C'est loin d'être simple !
Actuellement on développe une méthode native descendante (top-down à partir de la protéine intacte) capable de fournir des informations sur la structure de la protéine et sur différentes protéoformes en même temps. Elle nécessite cependant un matériel hautement sophistiqué et donc très coûteux.
La stratégie bottom-up part, quant à elle, des peptides -obtenus par digestion enzymatique - dont l'analyse en spectrométrie de masse (MS/MS) permet de remonter aux protéines après confrontation avec des banques de données. C'est la technique la plus utilisée.
"Because technology provides the tools and biology the problems, the two should enjoy a happy marriage"
Biologie ascendante

La recherche en biologie utilise généralement une analyse descendante : la cellule est un objet trop complexe et sophistiqué pour être analysée sans être décomposé conceptuellement.
Cependant, décomposer pour comprendre de bout en bout le fonctionnement des systèmes est une approche intéressante, mais ce n’est peut-être pas la meilleure façon de rendre un processus cellulaire plus performant - ou d’en produire un autre qui fasse la même chose mais de manière plus efficace.
Les biologistes se tournent donc de plus en plus vers la biologie ascendante. Avec les physiciens et chimistes, ils tentent de reconstruire les processus cellulaires en étudiant les composants. Ils pensent ainsi offrir de nouvelles perspectives et des solutions à des problèmes pendant de longue date.
Dans un numéro spécial, la revue Nature réunit une série d’articles qui analysent certains des défis, des opportunités et la complexité de ce domaine émergent.
In fine la question posée est celle-ci : la biologie ascendante permettra-t'elle de construire une «cellule» artificielle reproductrice à partir de zéro...
En biologie de synthèse

La biologie synthétique vise à assembler de nombreuses parties séparées dans des séquences complexes d'étapes élémentaires. Elle utilise à la fois des approches descendantes et ascendantes.
L’approche ascendante - bottom-up - permet aux biologistes de synthèse de construire des systèmes biologiques à partir de composants non issus du vivant.
La démarche appelée "Protocell" consiste en l'assemblage de composants artificiels afin de reproduire une cellule entière, artificielle et fonctionnelle. Les composants ne seront pas seulement des séquences d’ADN, mais des constituants cellulaires élémentaires : enzymes, ARN, ADN, voire chromosomes… intégrés dans vésicules lipidiques.
La recherche de protocellules a pour but de concevoir, de construire et de caractériser des structures micro-compartimentées qui partagent avec les cellules primitives ou les cellules vivantes modernes leur organisation statique et dynamique.
Le choix des entités moléculaires pour la construction de ces protocellules englobe des espèces strictement prébiotiques, semi-synthétiques ou entièrement synthétiques, bien qu'une hybridation entre ces approches soit souvent présente.
Les avancées récentes dans ce domaine ont permis de grandement améliorer la connaissance des conditions physico-chimiques et organisationnelles qui ont façonné ou favorisé le passage du non-vivant au vivant.
Pour aller plus loin...
Des codons aux duons : le double langage

Le code génétique possède un alphabet de 64 « lettres » que l'on nomme codons.
Une équipe de chercheurs de l'université de Washington a découvert que certains codons, que l'on a nommés « duons », peuvent avoir un double rôle.
Le premier, maintenant bien connu, est lié à la séquence des protéines, le second participe au contrôle génétique en instruisant les cellules sur la façon d'interpréter les gènes.
Ces duons sont donc des acteurs clés dans la construction de notre langage désoxyribonucléique en affectant à la fois la séquence de la protéine et le contrôle de l'organisation de gènes.
Ce n'est pas une petite découverte ! Elle aura des implications majeures sur la façon dont les scientifiques et les médecins interpréteront le génome d'un patient et ouvre de nouvelles portes pour le diagnostic et le traitement de la maladie.
Article complet ICI.
Voir aussi : "Les codes cachés qui façonnent l'évolution des protéines "
Chimie et Épigénétique...
Epigénétique

La chromatine est une structure dynamique qui doit répondre à des myriades de stimulis pour réguler l'accès à l'ADN. Les processus épigénétiques qui modulent cet accès en réponse à des signaux en amont, incluent la méthylation de l'ADN, la modification covalente des histones, le remodelage des nucléosomes, la dynamique nucléaire et les interactions de la chromatine avec les ARNs de régulation non codants.
Dans Nature de mars 2013, un point sur l'état de la science à propos de la "Dynamique de l'épigénome".
Les abeilles travailleuses polyvalentes... grâce aux transformations réversibles de leur ADN

L'étude du comportement des abeilles est plus que jamais un sujet d'actualité.
Une publication de la revue Nature Neuroscience rapporte les travaux de chercheurs qui viennent d'établir pour la première fois la relation entre leur fonction et une modification réversible d'ADN.
On sait que les abeilles travailleuses débutent comme infirmières, soignant et nourrissant la reine et les larves, puis peuvent devenir butineuses (*).
On sait aussi que ces deux types de comportement sont liés à une modification chimique (méthylation) de leur ADN.
Après avoir éliminé toutes les infirmières d'une ruche, les chercheurs ont observé qu'à leur retour, la moitié des butineuses pouvait se transformer en infirmières pour compenser cette disparition. A ce changement de rôle correspond une modification du type de méthylation de l'ADN et le processus est réversible.
(*) J'avais précédemment évoqué la hiérarchie au sein des butineuses.
Lire : Mémoire épigénétique et développement par Nathalie Dostatni