- AVANT-PROPOS
- A la UNE
- PRESENTATION
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- ACTUALITE ARTISTIQUE
- BLOG
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Médecine de demain
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- COVID-19 - Journal d'une pandemie - 11
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
" Oh ! combien efficace est la grâce qui réside dans les herbes, dans les plantes, dans les pierres et dans leurs qualités intimes !
Il n’est rien sur la terre de si humble qui ne rende à la terre un service spécial ; il n’est rien non plus de si bon qui, détourné de son légitime usage, ne devienne rebelle à son origine et ne tombe dans l’abus. La vertu même devient vice, étant mal appliquée, et le vice est parfois ennobli par l’action."
William Shakespeare, Roméo et Juliette
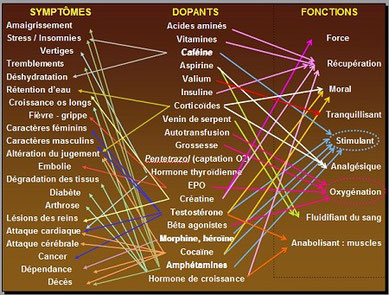
Molécules endogènes, exogènes, produits masquants, macromolécules... substances souvent à l'état de traces au sein de fluides biologiques eux-mêmes mélanges extrêmement complexes, la détection de produits dopants s'apparente à la recherche d'une tête d'épingle dans une botte de foin !
Heureusement, au fur et à mesure que les techniques de dopage se perfectionnaient, les outils de contrôle analytique devenaient de plus en plus performants.
J'ai déjà évoqué certains de ces outils, présents dans tout laboratoire de chimie du vivant : la spectrométrie de masse et la RMN, couramment utilisées comme techniques d'analyse et d'identification, aujourd'hui au service des recherches de pointe sur le protéome et le métabolome.
Avant de revenir sur leurs contributions à lutte antidopage, il me faut parler de quelques méthodes de séparation adaptées aux biomolécules.
Les méthodes chromatographiques

C'est au botaniste russe, Mikhaïl Semionovitch Tswett, que l'on doit la première séparation de composés par chromatographie (du grec khrôma et graphein, littéralement : écriture des couleurs).
En 1901, il sépara les pigments (chlorophylle, carotène), d'un extrait éthanolique floral, par percolation au travers d'un support solide composé de carbonate de calcium.
Il avait réalisé la première chromatographie d'adsorption liquide-solide sur colonne.
Dans cette technique, une phase mobile (l'éluant) entraîne plus ou moins vite les composants d'un mélange, déposé sur une phase stationnaire, en fonction de leurs affinités pour ce support. L'adsorption sur le support est due à des liaisons de type dipôle-ion, ou dipôle-dipôle ou liaison de Van der Waals.
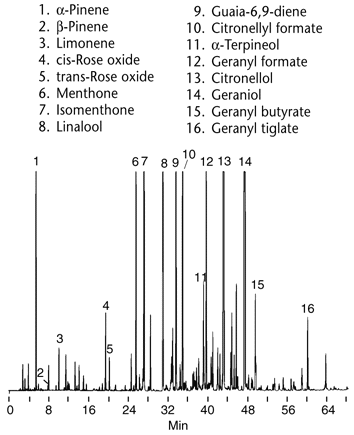
Depuis les techniques chromatographiques se sont développées et l'instrumentation est de plus en plus sophistiquée.
Les domaines d'application sont très vastes, de molécules très volatiles comme les terpènes extraits des huiles essentielles (ci-contre analyse d'une essence de géranium par chromatographie en phase vapeur), à des molécules d'intérêt biologique de poids moléculaire élevé.
De nombreuses variantes ont été développées :
- chromatographie de partage (entre phases liquides) qui valut le Prix Nobel de chimie à Archer John Porter Martin et Richard Laurence Millington Synge en 1952,
- d'échange d'ions,
- d'exclusion stérique...
Aujourd'hui la technique la plus utilisée dans un laboratoire de chimie du vivant est la HPLC (high performance liquid chromatography) qui utilise de hautes pressions.
L'électrophorèse
Encore une méthode séparative bien adaptée aux molécules d'intérêt biologique.
Le principe est simple : les espèces chargées migrent dans une solution d'électrolyte sous l'effet d'un champ électrique. Elles sont séparées en fonction de leur charge et de leur masse.
La méthode a été véritablement développée par le Suédois Arne Wilhelm Kaurin Tiselius qui reçoit le prix Nobel en 1948.
Sur ce principe de nombreuses techniques se sont développées, comme par exemple l'électrophorèse capillaire.
De la séparation à l'identification et au dosage
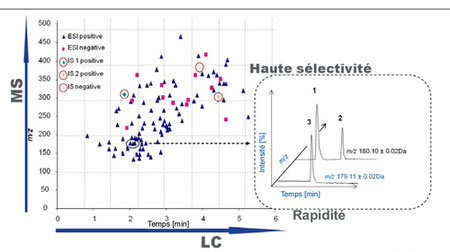
Dans les cas les plus simples l'identification des molécules recherchées peut-être obtenue directement à partir des chromatogrammes, notamment en déterminant les temps de rétention et en les comparant avec ceux archivés dans des bases de données.
Cependant, quand il s'agit de mélanges complexes de molécules de structures proches, le couplage des appareils de séparation avec un analyseur capable de donner une empreinte spectrale fiable, s'impose.
Le plus souvent ce couplage s'effectue avec un spectromètre de masse.
La LC-MS
J'ai donné quelques éléments à propos de cette technique quand j'ai évoqué les travaux concernant le protéome.
Le couplage chromatographie liquide - spectrométrie de masse (LC-MS) est devenue une technologie répandue au sein de tous les laboratoires cliniques de référence à l'échelle mondiale ; elle pénètre maintenant des unités de taille plus modeste. Ses applications dans les laboratoires d'analyses couvrent désormais des centaines de tests différents.
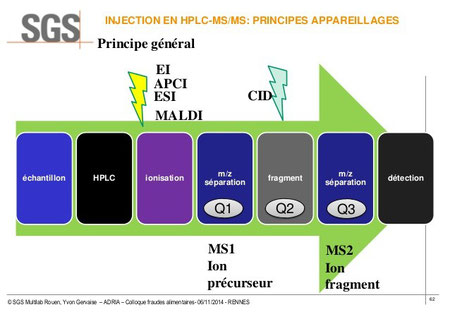
Une évolution importante est apparue plus récemment dans ces laboratoires : la technique dite en "tandem" ou LC-MS/MS.
Le principe de ce couplage est explicité sur le schéma et l'analyse ci-dessous.
L'appareillage type comprend :
- une séparation du mélange étudié par HPLC,
- l'introduction dans le spectromètre de masse avec plusieurs possibilités d'ionisation selon le type de molécule (impact électronique -EI-, ionisation chimique (APCI), électrospray (ESI), Matrix Assisted Laser Desorption Ionisation (MALDI),
- un premier filtrage par le spectromètre de masse qui fournit les ions précurseurs (Q1),
- une chambre de collision (Q2) remplie de gaz à basse pression qui induit une dissociation par collision (CID),
- une deuxième analyse par le spectromètre des ions fragments (Q3),
- le détecteur.
L'analyse par le spectromètre de masse permet donc d'abord d'obtenir la masse de toutes les molécules de l'échantillon (MS1) puis de fragmenter chacune d'elles (MS2) pour accéder à leurs structures.

Couplage avec la RMN
Encore plus récemment des combinaisons associant les trois techniques HPLC/RMN/MS (ci-contre) sont apparues dans des laboratoires de pointe.
L’implication de la RMN dans ces analyses permet notamment l'étude de suivi de métabolites dans les fluides biologiques et l'élucidation structurale de drogues modifiées.
En effet, avec la RMN, on peut obtenir un ensemble d'informations structurales sur la composition d'un mélange, sans impliquer un étalonnage préalable et sans recours à une base de données.
Les applications de l'électrophorèse
Les techniques électrophorétiques sont précieuses pour la détection de molécules de poids moléculaires élevées, comme l'EPO et les hormones de croissance.
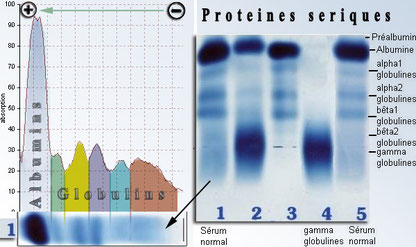
La première figure montre le résultat d'une électrophorèse sur gel permettant de détecter dans les urines l'EPO humaine et les EPO recombinantes.
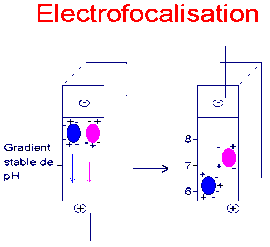
Pour identifier les EPO recombinantes, qui différent par les chaînes glycosylées disposées sur la protéine et qui ont donc des charges nettes différentes, on utilise l'isoélectrofocalisation. Dans un gel à gradient stable de pH, on fait migrer les protéines jusqu'à leur point isoélectrique pI (figure 2).
La technique actuelle consiste à effectuer une électrophorèse bi-dimensionnelle (figure 3) : après (ou avant) l'électrofocalisation, et dans une direction perpendiculaire, on effectue une deuxième séparation selon la masse molaire (en conditions dénaturantes qui permettent de déplier la chaîne polypeptidique).
Des séparations d'EPO par électrophorèse capillaire ont également été rapportées.
La lutte contre le dopage : du bon et du mauvais usage de la science

Afin de percer les mystères du vivant, de déchiffrer génome, protéome, métabolome... chimistes, physiciens, biologistes, informaticiens, ont mis en oeuvre des moyens considérables pour doter les laboratoires de plateaux techniques ultra-performants.
Dans quelques laboratoires de pointe, cet appareillage est au service de la lutte antidopage.
On pouvait donc penser que rapidement des progrès décisifs seraient accomplis pour éradiquer des pratiques qui pourrissent le sport et posent un vrai problème de santé publique.
Hélas celui qui connait le mieux le Dr Jekyll est... Mr Hyde.
Les Mr Hyde chimistes, biologistes, médecins... sont les mieux placés pour déjouer les pièges que lui tendent les Dr Jekyll !
On sait détecter l'EPO ? Qu'à cela ne tienne, on va synthétiser des petits peptides capables de mimer son actions en activant le récepteur !
Des peptides capables de mimer l’action de cette cytokine, à la fois in vitro et in vivo chez la souris, ont été mis en évidence.
Pour arriver à ce résultat, la méthode utilisée a été de construire une banque aléatoire de peptides fixée à la surface de phages. Cette banque a ensuite été incubée avec le récepteur de l’EPO et a entraîné la mise en évidence d’un peptide agoniste capable de se fixer au domaine extracellulaire du récepteur.
Ce n'est qu'un exemple parmi les multiples méthodes de contournement des tests antidopage.
En fait, la seule vraie solution est le suivi longitudinal (tout au long de l'année) des paramètres biologiques de tous les sportifs, et la mise en place de ce que l'on appelle le passeport biologique de l'athlète. Cela demande beaucoup de moyens et une détermination sans faille des instances sportives... qui furent parfois complices des dopés, notamment en cyclisme.